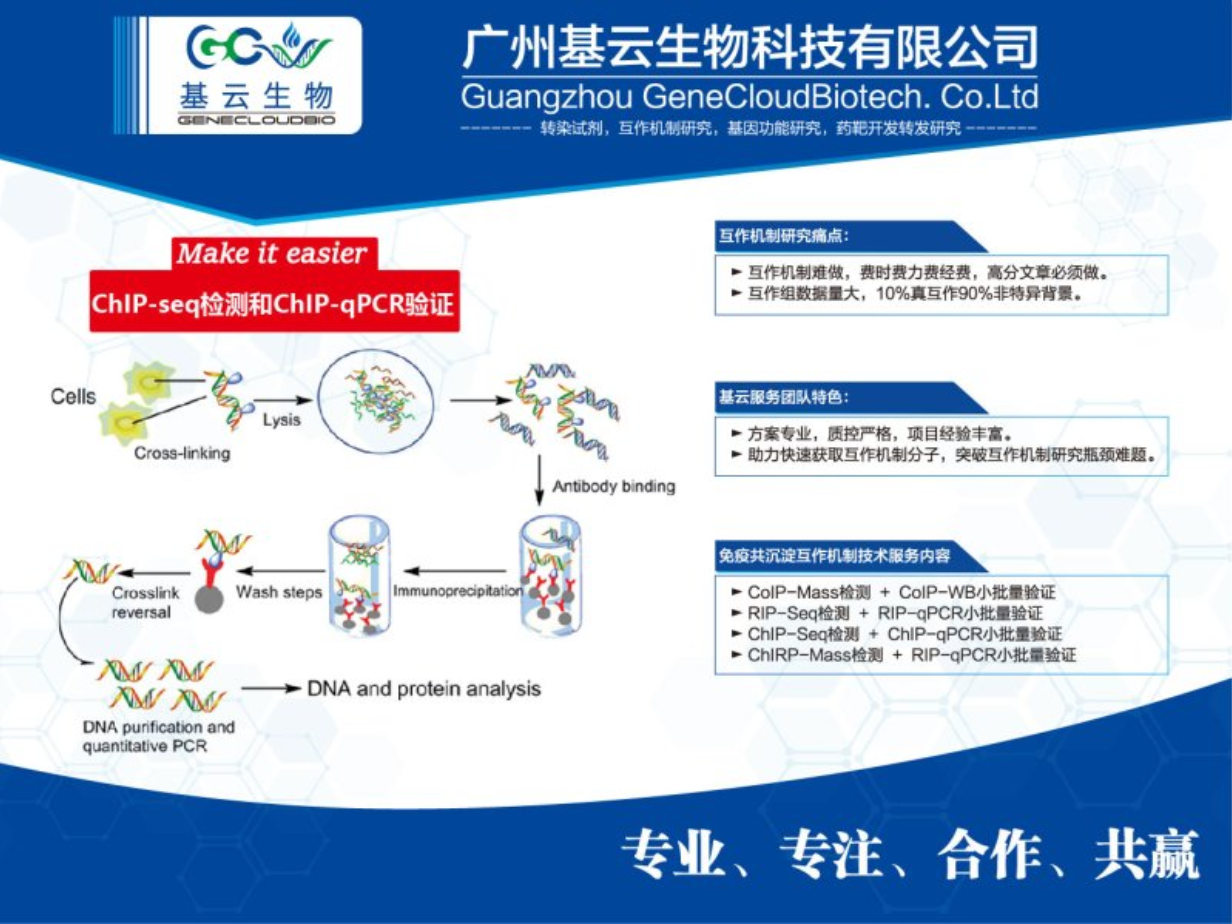
ChIP-qPCR实验流程主要包括以下步骤:交联与裂解:首先,将细胞或组织进行交联处理,以固定蛋白质与染色质的相互作用。常用的交联剂如甲醛。交联后,使用裂解缓冲液裂解细胞核,释放染色质的DNA。染色质片段化与免疫沉淀:接着,对染色质进行切割,生成适当大小的DNA片段,这些片段包含特定的蛋白质结合位点。然后,将特异性抗体加入样品中,与目标蛋白质结合形成免疫复合物。这些抗体是针对目标蛋白质的特异性抗体。洗涤与解交联:通过洗涤缓冲液去除非特异性结合物和杂质,保留具有特异性结合的免疫复合物。之后,通过加热或酶解等方法去除DNA与蛋白质之间的交联,释放DNA。DNA纯化与qPCR分析:使用DNA提取试剂盒等方法纯化免疫沉淀得到的DNA片段。随后,将提取的DNA片段进行qPCR反应,通过监测荧光信号变化,对目标基因进行定量分析。以上即为ChIP-qPCR实验的基本流程,实验结果可用于揭示蛋白质在基因组上的结合位点及转录调控机制。ChIP-seq与ChIP-qPCR都应用于研究蛋白质在基因组上的结合情况。广东chromosome免疫共沉淀ChIP
染色质免疫沉淀(ChIP)实验缺点和限制(二)。抗体特异性和可用性:ChIP实验依赖于特异性抗体来识别目标蛋白。然而,有时可能难以获得高质量、高特异性的抗体,特别是针对某些低丰度或新的蛋白。此外,某些蛋白可能在不同的细胞类型或条件下存在不同的修饰形式,这也可能影响抗体的特异性和实验结果。背景信号和假阳性:ChIP实验可能产生背景信号和假阳性结果。这可能是由于非特异性抗体结合、染色质裂解不完全或实验操作中的污染等原因引起的。为了减少背景信号和假阳性,需要优化实验条件、使用特异性强的抗体,并进行严格的实验设计和对照。技术限制:虽然ChIP实验可以提供有关蛋白质与DNA相互作用的信息,但它也有一些技术限制。例如,ChIP实验通常只能检测与特定抗体结合的蛋白-DNA复合物,可能无法检测到所有与目的基因结合的蛋白。此外,ChIP实验的结果也可能受到染色质可及性、交联效率等因素的影响。江苏ChIP测序染色质免疫沉淀(ChIP)实验的优点有哪些。
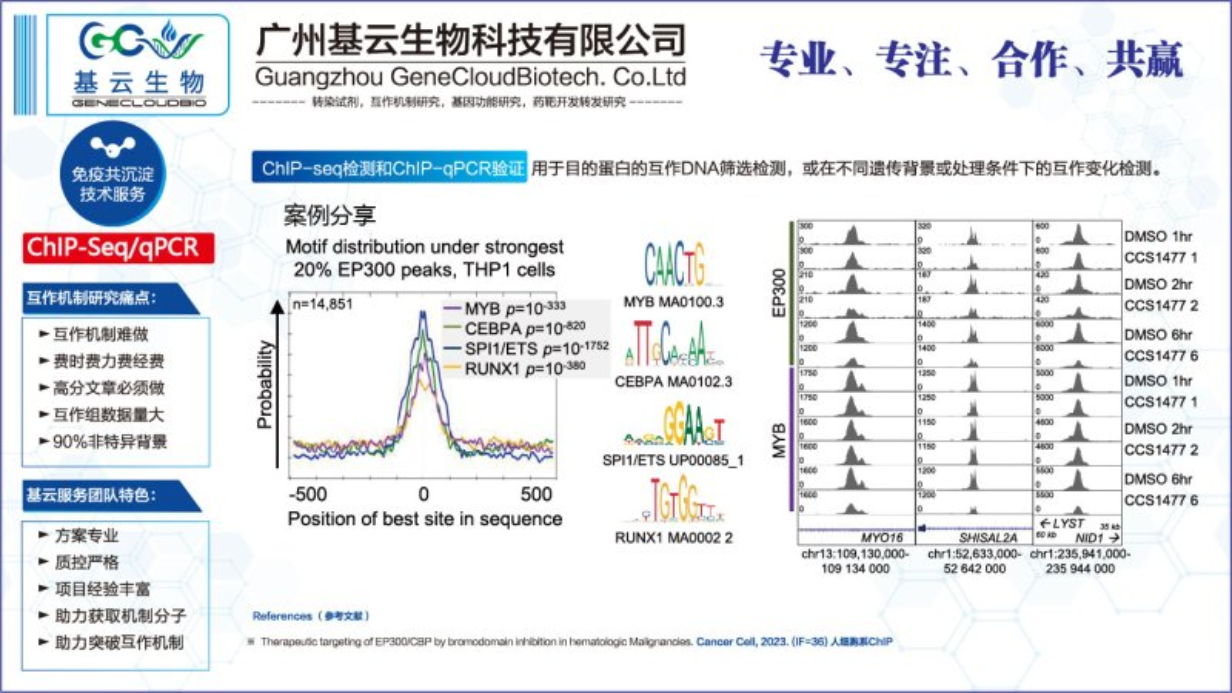
ChIP-seq与ChIP-qPCR在实验技术、分辨率和数据分析方面存在明显的不同之处。首先,ChIP-seq结合了高通量测序技术,能够在全基因组范围内检测蛋白质与DNA的结合位点。它通过测序仪对富集的DNA片段进行大规模并行测序,生成海量的数据,从而提供高分辨率的结合位点信息。相比之下,ChIP-qPCR则侧重于对特定基因或基因区域进行定量分析,它通过荧光定量PCR技术检测富集的DNA片段的数量,具有更高的灵敏度和特异性,但只能针对已知序列进行分析。其次,ChIP-seq在分辨率上优于ChIP-qPCR。由于ChIP-seq可以对全基因组进行测序,它能够检测到更多的结合位点,包括那些低丰度或远离转录起始位点的结合事件。而ChIP-qPCR则受限于所选择的基因或基因区域,可能无法全局反映蛋白质在基因组上的结合情况。在数据分析方面,ChIP-seq生成的数据需要进行复杂的生物信息学分析,包括序列比对、峰值调用、注释和富集分析等步骤。而ChIP-qPCR的数据分析相对简单,主要通过比较不同样品间的荧光信号强度来判断蛋白质的结合情况。
在考虑进行ChIP-qPCR实验时,通常涉及以下情况:验证特定蛋白质与DNA的结合:当你有明确的假设,认为某个特定的转录因子、组蛋白或其他染色质相关蛋白质与某个基因或基因区域结合时,ChIP-qPCR是一种有效的验证方法。定量分析蛋白质与DNA的结合程度:ChIP-qPCR允许你对特定基因或基因区域的蛋白质结合进行定量分析,这对于比较不同条件下(如不同时间点、不同处理或不同细胞类型)的结合差异特别有用。研究少量基因或特定区域:与ChIP-seq相比,ChIP-qPCR更适用于研究少量基因或特定基因区域,因为它更经济、更快速,并且对于特定目标的检测具有更高的灵敏度。资源有限:当你没有足够的资源或时间进行全基因组的ChIP-seq分析时,ChIP-qPCR可以作为一个更可行且成本效益更高的选择。初步筛选或验证:在进行更大规模的ChIP-seq实验之前,ChIP-qPCR可以作为初步筛选或验证特定蛋白质与DNA结合位点的有效工具。在这些情况下,ChIP-qPCR提供了一种灵活、敏感且经济高效的方法来研究蛋白质与DNA的相互作用。转录因子调控下游靶基因研究方法有哪些。
Q:ChIP-Seq和ChIP-qPCR有何异同?A:染色质免疫共沉淀(ChIP)所获得的DNA产物,在ChIP-Seq中通过高通量测序的方法,在全基因组范围内寻找目的蛋白(转录因子、修饰组蛋白)的DNA结合位点片段信息;ChIP-qPCR需要预设待测的目的序列,针对目的序列设计引物,以验证该序列是否同实验蛋白结合互作。
Q:染色质片段大小在哪个范围比较合适?A:对于ChIP-seq,片段在200-500bp左右是合适范围;对于ChIP-qPCR,片段在200-800bp左右适宜。
Q:植物样本处理和动物组织/细胞有何区别?A:植物组织由于细胞壁、气腔等结构的存在,会给交联缓冲液的作用带来困难,因此相对于动物组织/细胞来说,往往需要在抽真空条件下进行交联,而该步奏是一个需要经验及优化的过程。
Q:ChIP-Seq中的测序DNA样本需要多少产量?A:通常是≥10ng。
Q:ChIP风险如果判断A:ChIP实验以标签来判断实验风险,重组标签的转录因子>内源转录因子>组蛋白;当以重组蛋白作为靶蛋白时,重组蛋白同内源蛋白可能存在结合活性、结合位点差异;以标签抗体进行ChIP时、染色质结合位点本身会被内源蛋白竞争,这些都会影响到ChIP过程的特异性捕获效率。 ChIP实验是基于抗原-抗体反应的特异性,结合染色质的结构特性,从而研究蛋白质与DNA在染色质上的相互作用。江苏ChIP测序
ChIP-seq(染色质免疫沉淀测序)是一种强大的实验技术,广泛应用于多个生物学领域。广东chromosome免疫共沉淀ChIP
在染色质免疫沉淀(ChIP)实验过程中,可能遇到的问题及其解决方案(一)。染色质裂解不完全:可能导致DNA与蛋白质之间的结合不稳定,影响实验结果。解决方案:优化裂解液配方、调整裂解时间和温度,以及确保使用新鲜且状态良好的细胞或组织样品。抗体特异性不足:若抗体不能特异性地识别目标蛋白质,可能导致非特异性结合和假阳性结果。解决方案:选择特异性好、质量可靠的抗体,并进行抗体验证实验。免疫沉淀效率低:可能是由于抗体与染色质结合不充分或洗涤步骤不当导致的。解决方案:增加抗体用量、优化免疫沉淀时间和温度,以及调整洗涤条件和次数。广东chromosome免疫共沉淀ChIP