ChIP-seq实验虽然是一种强大的研究蛋白质与DNA相互作用的技术,但也存在一些缺点。首先,ChIP-seq实验需要大量的起始材料,通常需要数百万个细胞,这对于某些稀有或难以培养的细胞类型来说是一个挑战。其次,ChIP-seq实验的过程相对复杂,需要经过多个步骤,包括细胞交联、染色质片段化、免疫沉淀、文库构建和高通量测序等。每个步骤都可能引入误差或偏差,需要仔细优化和控制实验条件。此外,ChIP-seq实验的结果受到抗体特异性和亲和力的影响。如果使用的抗体质量不高或与目标蛋白质的结合不够特异和紧密,可能会导致结果的假阳性或假阴性。另外,ChIP-seq实验的数据分析也是一个挑战。由于测序产生的数据量庞大,需要专业的生物信息学知识和技能进行有效的数据处理和解读。同时,ChIP-seq实验的结果通常需要在基因组注释、转录因子结合位点数据库等多个层面进行整合和验证,以确保结果的准确性和可靠性。综上所述,尽管ChIP-seq实验是一种强大的技术,但在实际应用中需要考虑其局限性,并仔细设计实验方案、优化实验条件、选择合适的抗体和进行有效的数据分析。ChIP实验注意事项有哪些。ChIP Sequence检测

在考虑进行ChIP-qPCR实验时,通常涉及以下情况:验证特定蛋白质与DNA的结合:当你有明确的假设,认为某个特定的转录因子、组蛋白或其他染色质相关蛋白质与某个基因或基因区域结合时,ChIP-qPCR是一种有效的验证方法。定量分析蛋白质与DNA的结合程度:ChIP-qPCR允许你对特定基因或基因区域的蛋白质结合进行定量分析,这对于比较不同条件下(如不同时间点、不同处理或不同细胞类型)的结合差异特别有用。研究少量基因或特定区域:与ChIP-seq相比,ChIP-qPCR更适用于研究少量基因或特定基因区域,因为它更经济、更快速,并且对于特定目标的检测具有更高的灵敏度。资源有限:当你没有足够的资源或时间进行全基因组的ChIP-seq分析时,ChIP-qPCR可以作为一个更可行且成本效益更高的选择。初步筛选或验证:在进行更大规模的ChIP-seq实验之前,ChIP-qPCR可以作为初步筛选或验证特定蛋白质与DNA结合位点的有效工具。在这些情况下,ChIP-qPCR提供了一种灵活、敏感且经济高效的方法来研究蛋白质与DNA的相互作用。DNA蛋白互作ChIP Seq染色质免疫沉淀(ChIP)实验缺点和局限性有哪些。
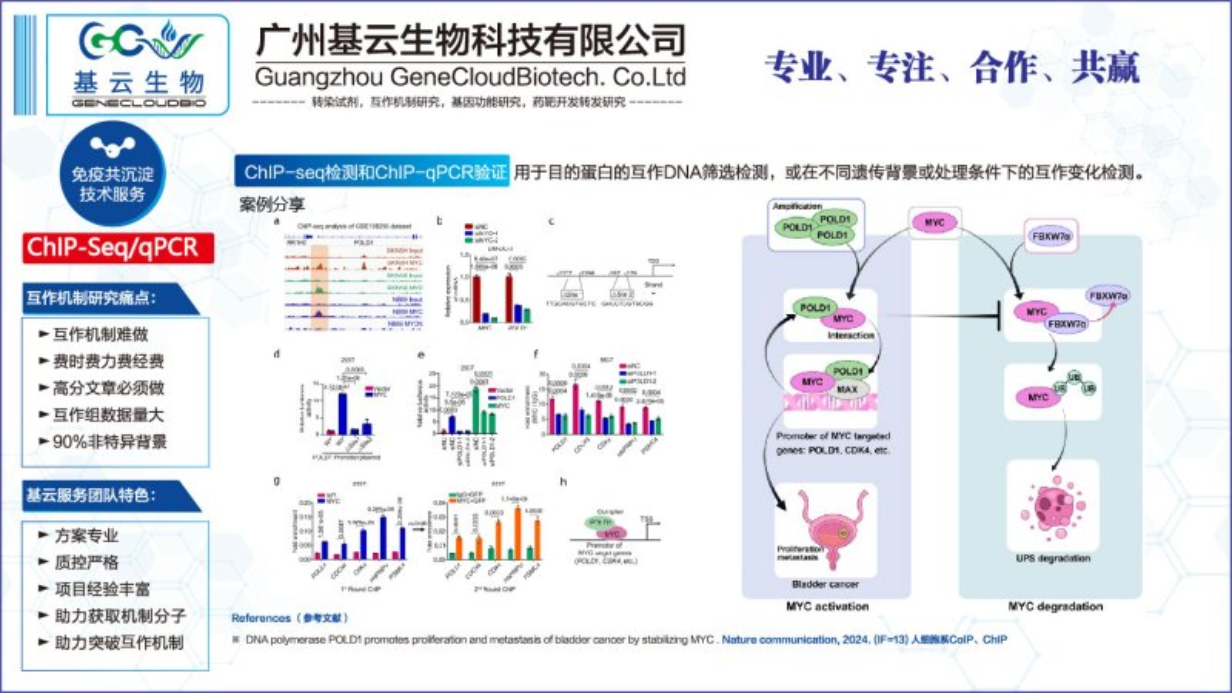
ChIP-seq与ChIP-qPCR在实验技术、分辨率和数据分析方面存在明显的不同之处。首先,ChIP-seq结合了高通量测序技术,能够在全基因组范围内检测蛋白质与DNA的结合位点。它通过测序仪对富集的DNA片段进行大规模并行测序,生成海量的数据,从而提供高分辨率的结合位点信息。相比之下,ChIP-qPCR则侧重于对特定基因或基因区域进行定量分析,它通过荧光定量PCR技术检测富集的DNA片段的数量,具有更高的灵敏度和特异性,但只能针对已知序列进行分析。其次,ChIP-seq在分辨率上优于ChIP-qPCR。由于ChIP-seq可以对全基因组进行测序,它能够检测到更多的结合位点,包括那些低丰度或远离转录起始位点的结合事件。而ChIP-qPCR则受限于所选择的基因或基因区域,可能无法全局反映蛋白质在基因组上的结合情况。在数据分析方面,ChIP-seq生成的数据需要进行复杂的生物信息学分析,包括序列比对、峰值调用、注释和富集分析等步骤。而ChIP-qPCR的数据分析相对简单,主要通过比较不同样品间的荧光信号强度来判断蛋白质的结合情况。
开展ChIP-qPCR实验时,应注意以下几个问题:实验设计:要有明确的实验目的,设计合理的对照组,比如设立IgG对照组以排除非特异性结合的影响。样品质量:保证使用的细胞或组织样品新鲜,且数量足够,避免因样品质量问题导致实验失败。抗体选择:选用高特异性和效价的抗体至关重要,要进行抗体的预实验验证其有效性。操作细节:严格按照ChIP的实验步骤进行操作,特别是在染色质片段化、免疫沉淀和洗涤过程中要控制条件,确保实验的重复性和准确性。避免污染:实验中要避免样品间的交叉污染和外界DNA的污染,使用无菌操作和无核酸酶的试剂。数据分析:在qPCR阶段要确保引物的特异性和扩增效率,对数据进行归一化处理,结合生物学背景和统计学方法进行合理解读。结果验证:建议通过多次重复实验进行结果的验证,增强实验结论的可靠性。安全防护:实验过程中要佩戴手套和防护眼镜,避免接触有毒有害试剂,确保实验室安全。通过注意这些问题,可以提高ChIP-qPCR实验的成功率和数据质量。ChIP实验(染色质免疫沉淀实验)的一般实验流程主要包括哪些步骤。

ChIP实验关键步骤1)细胞的准备及固定细胞在培养皿上生长到80%~90%。当做实验时,可以同时准备两个培养皿,一个用于预测细胞数量(细胞量为1E5),另外一个用于优化超声条件。2)染色质超声断裂加入SDS裂解溶液重悬沉淀,在冰上放置10min,每隔1min颠倒摇动离心管。SDS能裂解细胞膜和核膜,使固定染色质释放出来,这样有利于超声。3)免疫沉淀蛋白和DNA复合物所有染色质免疫沉淀步骤都必须低温(冰上或4℃)操作。使用ChIP稀释溶液把超声染色质液体稀释10倍,这样有利于免疫沉淀反应。为了减少非特异性结合蛋白背景,往2mL超声稀释液中加入20μL蛋白A/G琼脂糖珠(Protein A/G Agarose Beads),在4℃摇床轻柔摇动1h。4)洗脱、解交联从这一步开始,所有操作都在室温进行。在洗脱步骤完成后吸取洗脱上清时要格外注意,防止吸走微珠而造成样品污染。同时要注意每个样品管吸取等量的上清,防止造成样品间误差。5)DNA纯化DNA纯化可以通过酚/氯仿抽提或者通过硅胶柱纯化。6)鉴定一旦完成了DNA纯化,便可进行多种下游分析,包括ChIP-PCR、ChIP-qPCR、ChIP-芯片和ChIP-seq。ChIP-qPCR和ChIP-seq在实验流程、分辨率和应用范围上存在异同点,应根据具体需求选择合适的技术方法。湖南互作机制ChIP
通过ChIP-qPCR分析转录因子结合位点的富集程度,为转录因子结合位点的功能研究提供实验依据。ChIP Sequence检测
ChIP实验主要分为ChIP-qPCR和ChIP-seq两大类。ChIP-qPCR是一种结合了染色质免疫沉淀(ChIP)与实时荧光定量PCR(qPCR)的技术。它用于检测特定蛋白质(如转录因子)与特定DNA序列的结合情况,通过ChIP富集与目的蛋白结合的DNA片段,随后用qPCR技术对这些片段进行定量检测,以验证蛋白质与特定基因区域的结合关系。ChIP-qPCR适用于已知蛋白质与靶序列相互作用的研究,具有较高的灵敏度和特异性。而ChIP-seq则结合了ChIP与高通量测序技术,在全基因组范围内检测与特定蛋白质结合的DNA区域。该技术可以绘制出转录因子等蛋白质在全基因组范围内的结合位点图谱,对于未知靶序列的研究尤为重要。ChIP-seq能够提供更完整、高分辨率的结合信息,是探索转录调控网络、表观遗传机制等领域的有力工具。总的来说,ChIP-qPCR和ChIP-seq都是研究蛋白质与DNA相互作用的重要技术,选择使用哪种技术取决于研究的具体目标和需求。ChIP Sequence检测