卵巢早衰模型的建立
临床的卵巢早衰(POF)是指卵巢功能提前减退,常见为女性在40岁以前出现闭经,以闭经,不育,雌***缺乏以及**水平升高为特征的一种疾病。在人群中发病率为1%~3%,在继发性闭经中占2%~10%,诊断以至少半年或半年以上闭经多次发生,排除其他原因为基础,卵巢早衰是妇科分泌领域的常见病。
英瀚斯生物可承接各种生殖系统相关实验动物模型。
一.实验方法:
方法一:顺铂诱导大鼠卵巢早衰模型取雌性8周龄SD大鼠,适应性饲养7d。腹腔注射顺铂2mg/kg,连续注射7d。
方法二:环磷酰酸诱导大鼠卵巢早衰模型取雌性8周龄SD大鼠,适应性饲养7d。使用环磷酰酸给予腹腔注射,***次剂量为50mg/kg,以后8mg/kg连续注射14d。 英瀚斯生物 实验动物模型整体外包。新疆大鼠实验动物模型怎么样

实验动物模型的灌注取材方法:
小鼠灌注灌流
固定小鼠时我一般采用输液器的针头(4号半,这样肉眼可见就是肺部明显充气胀大变白,针头要从心轴方向进针,刺入心尖3~4毫米左右就可以了,开始灌流后剪破右心耳,约40毫升生理盐水,后再灌流约20毫升多聚甲醛,整个灌流固定的过程就完成了。
英瀚斯生物,从动物模型造模、取材到后续病理切片染色、分子检测一站式搞定!
大鼠灌注
按大鼠体重,用2%戊巴,比妥钠(0.25ml/100g)进行腹腔注射麻醉,开胸暴露心脏,向左心室内注射1%肝素钠0.2ml后经左心室行主动脉插管,血管钳固定后剪开右心耳,先以生理盐水150ml快速冲洗血管,然后用4%多聚甲醛的0.01mol/LPBS(4℃,PH7.40)250ml灌注固定,先快后慢,共需时间为50min,之后取材,置4%多聚甲醛固定液后固定,在4℃冰箱内保存。多聚甲醛进入大鼠体内,大鼠会出现四肢、尾的抽搐,**终以肝脏发白、内脏鼓起即灌注好。 广东常见实验动物模型哪家好英瀚斯生物,可做实验动物模型验证药物效果实验。
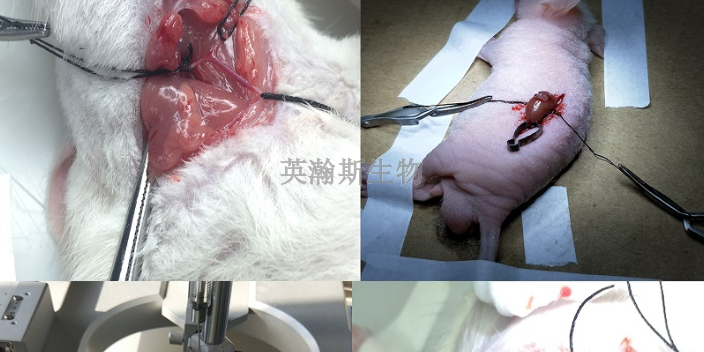
实验动物模型的案例。反义寡核苷酸(ASOs)是一种短的、化学合成的单链寡核苷酸,通过对其骨架和糖基进行修饰,可增加其稳定性、药理特性以及与靶标的结合,并通常具有较小的毒性。常用于细胞和动物体内基因功能研究以及ASO核酸药物的开发等。经过化学修饰的ASOs可以通过多种作用机制发挥作用。常见的一种作用方式是与RNA结合,形成RNA&DNA杂合体,依赖于RNase H发挥作用,从而导致靶标mRNA的降解,主要适用于干扰细胞核内的lncRNA/circRNA/mRNA等。
二型糖尿病实验动物模型:胰岛素抵抗和胰岛β细胞的功能缺陷胰岛素分泌异常
诱导方法一:小剂量STZ加高脂饲料诱导糖尿病模型。高脂饲料喂养4周后,腹腔注射STZ(30mg/kg),1周后选空腹血糖大于11.1mmol/L。
英瀚斯专业承接实验动物模型,欢迎实地考察实验室,来电咨询。
诱导方法二:转基因老鼠db/db小鼠:糖尿病小鼠(C57BL/KsJdb/dbmouse)也为Jackson实验室于1966年在C57BLKS/J(BKS)近交系中发现的自发性突变小鼠,该小鼠高糖、多尿及高尿糖水平的表型与人类的糖尿病患者非常相似。在10~14天出现高胰岛素血症,3~4周明显肥胖,在10周时可达野生小鼠的2~3倍,但身长比野生型短5%,并有高胆固醇血症和高甘油三酯血症。4~8周出现高糖血症,且表现出多食、消渴、多尿的典型糖尿病临床表现。 英瀚斯生物,承接小鼠实验动物模型。
5胃炎实验动物模型
5.1萎缩性胃炎动物模型【操作步骤】SD或Wistar大鼠均可,收集同种同系大鼠的胃黏膜,去除食物残渣,用生理盐水洗净,快速混合均匀,置4℃冰箱放置1h后,3000转/分,离心15min,取上清液,测定蛋白浓度,调整浓度为200mg/ml作为抗原,与等量的弗氏完全佐剂乳化,注入大鼠大腿皮下,2次/周,隔周注射,剂量为10mg蛋白/次,观察萎缩性胃炎的发生。【结果分析】该方法造成大鼠胃黏膜的免疫损伤导致胃黏膜萎缩,制模成功率高、重复性好、病理结果可靠。
5.2化学物质诱发的急性胃炎大鼠模型【操作步骤】成年Wistar或SD大鼠,术前禁食24h。以20mmol/L的阿司匹林或水杨酸溶液按100mg/kg体重灌胃。或以10mmol/L的醋酸、不同浓度的盐酸(1、10、100mmol/L)、2mmol/L的牛磺胆酸、l5%的乙醇等单独或几种合用灌胃。在4h后取材见胃内发生急性弥漫性炎症变化。5.3幽门螺杆菌***的动物模型1.幽门螺杆菌***的悉生乳猪动物模型
【操作步骤】将从胃溃疡病人中分离到的幽门螺杆菌(Hp)1000000个经口接种于剖腹产净化的乳猪,3d后再接种1000000个细菌。
【结果分析】所有实验乳猪上消化道中都可分离出Hp,而回肠末端、结肠和粪便中均为阴性。 实验动物模型后续检测。内蒙古实验动物模型实验
英瀚斯生物,专业技术团队,熟练掌握各类实验动物模型构建。新疆大鼠实验动物模型怎么样
新一代AD(阿尔兹海默症)实验动物模型。尽管APP-Tg小鼠在过去十几年中范围广的被用于开发新的AD医疗策略,但这种小鼠的基因表型和AD患者的还是不同。而且上述的转基因动物模型在Aβ的生成、tau蛋白的过度磷酸化、神经纤维缠结等病理特征上和AD患者的差异也很大,无法理想地模拟AD患者。为了克服这些不希望出现的问题,研究人员构建了带有Swedish(KM670/671NL)、Beyreuther/Iberian(I716F)和Arctic突变等APP基因敲入(APP-KI)小鼠。APP-KI小鼠在没有过度表达APP的情况下生成Aβ42。随着年龄的增长,APP-KI小鼠大脑皮层和海马区出现过多的Aβ沉积。另一方面,与其他AD模型一样,该模型没有tau病理、NFTs、神经退行性变或大量神经元丢失可用于研究临床前AD。由于基因组编辑的新的进展,尤其是CRISPR/Cas技术,未来对转基因动物模型进行改良也值得期待。新疆大鼠实验动物模型怎么样