脂质体靶向递送中叶酸配体修饰脂质与生物活性小分子(如叶酸)的结合已被研究用于靶向递送核酸。例如,由叶酸与1-棕榈酰-2-油酰-sn-甘油-3-非共价结合而形成的脂质体乙基磷脂胆碱:胆固醇脂质体显著提高胸苷激酶质粒DNA转染效率,抑制体外TSA和SCC7细胞生长。这些叶酸相关的脂质体在移植SCC7**的小鼠中显示出较高的抗**效果。在另一种方法中,叶酸标记的阳离子脂质体与小牛胸腺DNA复合物***巨噬细胞,与不含叶酸的普通阳离子脂质体相比,显示出更高的DNA叶酸受体表达细胞的递送。在荷瘤小鼠中,与不含叶酸的脂质体相比,叶酸标记的脂质体诱导干扰素-g和白细胞介素-6的产生,延长了存活时间。甘草次酸已被用于靶向肝细胞肝*细胞,基于一项研究表明,与邻近的非**肝细胞相比,甘草次酸的结合靶点蛋白激酶C在肝细胞*细胞表面的表达更高。合成了甘次酸-次酸-聚乙二醇-聚胆甾醇缀合物,并将其与DOTAP和胆固醇配制成阳离子脂质体。这些脂质体与表达GFP的质粒DNA形成复合物的能力更高,并且与缺乏甘次酸的对照阳离子Lipo脂质体相比,能增强质粒DNA转染至肝*细胞的能力。Arg-Gly-Asp (RGD)肽修饰的脂质体增强核酸靶向整合素受体表达细胞传递的能力。LNP脂质体载药mRNA
寡核苷酸脂质体
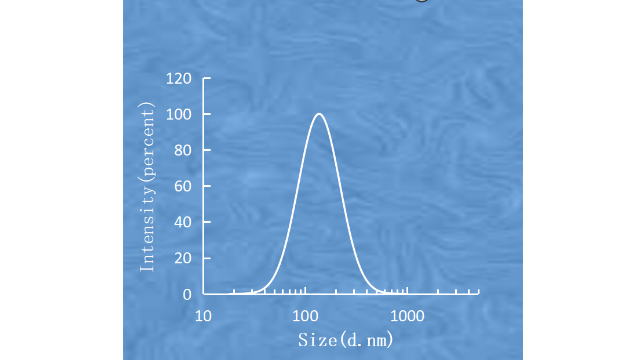
寡核苷酸是一种<50个碱基的短核酸聚合物。AS-ODN(反义寡脱氧核苷酸)是与互补的mRNA序列结合的单链DNA或RNA。由于AS-ODNs可以下调某些RNA并抑制靶蛋白的表达,因此它们被认为具有作为核酸药物的潜力。然而,为了开发基于寡核苷酸的***方法,必须克服寡核苷酸在生理环境中的不稳定性及其细胞摄取不足的问题。Zhang及其同事开发了由1,2-二油酰基-3-三甲铵基丙烷(DOTAP)、磷脂酰胆碱和胆固醇组成的阳离子脂体,用于针对Raf-1蛋白丝氨酸/苏氨酸激酶(一种已知的*****靶标信号蛋白)的AS-ODNs全身递送。他们观察到,全身给药AS-ODNs与阳离子脂质体复合物可降低肝脏和**组织中Raf-1蛋白的表达,并抑制小鼠PC-3**的生长。在另一项研究中,bcl2特异性AS-ODNs与鱼精蛋白和阳离子脂质体(由DC-Chol、磷脂酰胆碱和DSPE-PEG2000组成)络合。脂质体***增加Bcl-2AS-ODNs的细胞摄取,导致Bcl-2蛋白水平***下调。研究了AS-ODNs和阳离子脂质体***特应性皮炎的疗效。将靶向白介素-13的AS-ODNs与DOTAP和胆酸钠组成的阳离子脂质体配合,局部应用于特应性皮炎小鼠皮损。这种***剂量依赖性地缓解了特应性皮炎,200ugIL-13的AS-ODNs的抑制作用比较大。 微流控脂质体载药靶向肽脂质体的粒径和粒径分布的检测。
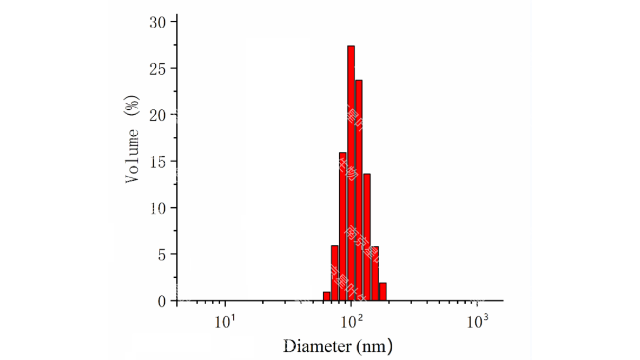
脂质体质量控制的重要性与常规药物剂型(如⼩分⼦注射溶液)不同,脂质体中装载的***性分⼦在全⾝给药后(如静脉注射)转运到肿瘤细胞的过程更为复杂主要经历以下⼏个步骤:(1)从⾎管内间隙外渗到组织间质:脂质体通过扩散和/或对流穿越**⾎管壁不连续的内⽪连接点(100nm-2µm)进⼊**间质。同时⼀部分脂质体被MPS从体循环中***,特别是对于⼤尺⼨(>200nm、疏⽔和带电颗粒表⾯(带负电荷或正电荷)的颗粒。(2)通过扩散和对流进⾏间质运输,以接近单个肿瘤细胞。利⽤主动靶向对脂质体进⾏表⾯修饰将克服颗粒在细胞外基质(ECM)中扩散的物理阻⼒,因为颗粒上的靶向配体与肿瘤细胞表⾯的受体之间产⽣了更⾼的亲和⼒(3)通过⾮特异性或特异性结合的⽅式附着于细胞膜(4)通过内吞作⽤、膜融合或扩散进⼊细胞。内吞作⽤的途径取决于颗粒⼤⼩即⼤⼩为200nm,500nm的颗粒为⽹格蛋⽩介导的内吞作⽤和⼩泡介导的内吞作⽤,⼤胞吞作⽤可达5µm。(5)细胞内转运和药物释放。基于脂质体的这种运输过程由于循环脂质体颗粒⽆法穿过⼼脏⾎管的连续内⽪连接,与传统的阿霉素给药相⽐,Doxil明显降低了⼼脏毒性。与常规药物相⽐DaunoXome可使多柔⽐星的**递送量增加约10倍,并在体内提供持续释放。
阳离子脂质体的递送的优势各种基于核酸的分子已被研究作为下一代***药物,包括质DNA,反义寡脱氧核苷酸(as-odn),小干扰RNA(siRNA)和微RNA(miRNA)。这些分子共享各种物理化学性质,比化学药物更大,并且携带高度负电荷,限制了它们的细胞递送。因此,核酸疗法要想取得成功,就必须在识别合适的靶蛋白的同时,开发新的递送系统。质粒DNA是**早被认为用于***目的的核酸之一,长期以来一直在基因***的背景下进行研究。在此背景下,研究人员已经将重点放在病毒载体上,它可以赋予高转染效率和基因表达的连续调节。然而,Gelsinger在使用腺病毒载体的临床试验中不幸死亡,让人们意识到病毒材料可能并非完全安全。此外,病毒载体作为候选药物有几个缺点,例如需要为每个靶分子设计载体的不便,以及缺乏关于细胞表达剂量依赖性的知识。脂质与生物活性小分子(如叶酸)的结合已被研究用于靶向递送核酸。
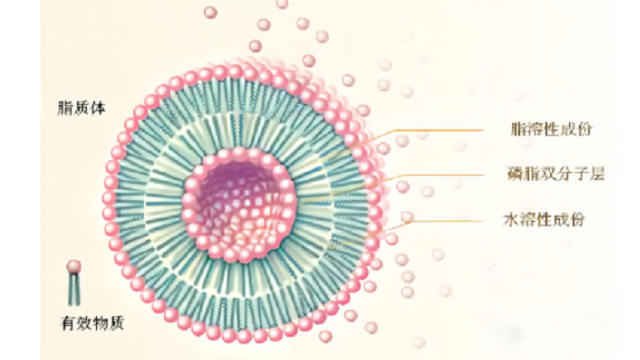
脂质体共价连接药物-脂质偶联载***式通过连接剂将药物分⼦与脂质共价连接是另⼀种在脂质体内装载药物的有效策略,例如Mepact。MDP是主要⾰兰⽒阳性菌细胞壁的组成部分,具有****应答的作⽤。
柔红霉素利⽤铜(gulconate)2/TEA负载⽅法在脂质体内主动积累。柔红霉素通过脂质双分⼦层扩散到脂质体内,⽽中性形式的TEA则渗透到脂质体外,在柔红霉素和TEA外排之间建⽴了动⼒学和化学计量学关系。Cu(葡糖酸盐)2/TEA在与这两种药物相互作⽤中起关键作⽤,保持药物在脂质体内的保留并调节药物从脂质体中的释放。 固体脂质纳米颗粒和纳米结构脂质载体的区别。广西脂质体载药公司代做
质粒DNA要在细胞内被有效地翻译,质粒DNA必须经过有效的细胞内运输进入细胞质,并从细胞质进入细胞核。LNP脂质体载药mRNA
脂质体的载药率脂质体的载药率是指单位质量的脂质体所能承载的药物量。它是评估脂质体药物传递效果的重要指标之一,通常通过药物在脂质体中的含量或释放速率来表征。脂质体的载药率受多种因素影响,包括脂质体的组成、结构、制备方法以及药物本身的性质。以下是影响脂质体载药率的一些关键因素:1.脂质体组成:脂质体的组成对其载药率有重要影响。磷脂质的类型和含量、胆固醇的含量、表面活性剂的种类等都会影响脂质体的药物承载能力。2.药物的性质:药物的溶解度、分配系数、分子大小等性质会影响其在脂质体中的溶解和扩散,进而影响载药率。3.载***法:载***法的选择会影响到药物与脂质体之间的相互作用和药物的分布。常见的载***法包括共混法、溶剂溶解法、膜溶解法等。LNP脂质体载药mRNA