脂质体靶向递送中**核靶向功能已知**具有核靶向功能。为了增强质粒DNA的核转运,**与PAMAM树状大分子偶联,与DOPE(1:1)混合形成脂质体。与聚亚胺相比,PAMAM-**/DOPE阳离子脂质体增强了HEK293细胞中质粒DNA的表达,并显示出较低的细胞毒性(m.w.25,000)。总的来说,靶向配体的修饰可以帮助实现特异性靶向,避免非特异性分布到肝脏和其他组织。然而,从商业化的角度来看,配体定制技术仍然面临许多障碍,包括需要更流线型的制造工艺和改进的质量控制。脂质体表⾯修饰的作用。合成脂质体载药血管

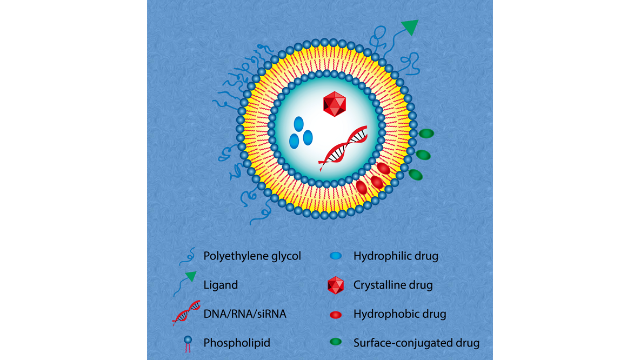
4PEG2000在脂质体中的作用
PEG2000是一种聚乙二醇(PEG)衍生物,常用于脂质体的表面修饰。它在脂质体中具有多种作用:1.稳定性增强:PEG2000可以在脂质体表面形成一层稳定的水合层,防止脂质体的聚集和沉淀,从而提高其在溶液中的稳定性。2.血液循环延长:脂质体表面修饰PEG2000可以降低脂质体被吞噬的速度,延长其在血液循环中的半衰期,从而增加药物的生物利用度。3.免疫原性降低:PEG2000可以掩盖脂质体表面的亲水性基团,减少脂质体与免疫系统的识别和***,降低免疫原性,提高脂质体的生物相容性。4.药物释放调控:PEG2000修饰的脂质体可以通过改变PEG链的长度和密度来调控药物的释放速率和方式,实现对药物的精确控制释放。在Doxil和Onivyde中,甲氧基peg(Mw2000Da)与DSPE(MPEG-DSPE)共价结合,提供了“隐形”和空间稳定的脂质体。PEG的分⼦量和PEG-DSPE在脂质组成中的摩尔百分⽐对双层填料、循环时间和热⼒学稳定性有重要影响。⾼分⼦量的PEG(>2000Da)移植到脂质头群上,表现出来⾃脂质体表⾯的排斥⼒,并保护脂质体不与⾎清蛋⽩结合,避免被单核吞噬系统(MPS)进⼀步***,但也减少了靶细胞对脂质体的相互作⽤和内吞作⽤。 企业脂质体载药制备脂质体是由多种组分构成的,主要包括:磷脂质、胆固醇、表面活性剂和PEG2000等。
主动药物装载⽅法,也称为远程药物装载⽅法,涉及在空脂质体产⽣后装载药物制剂。pH值或离⼦浓度的跨膜梯度是促进药物跨膜扩散进⼊脂质体内核的驱动⼒。药物包载过程⼤约需要5~30分钟,可达到较⾼的装载效率(90%以上)。Doxil是基于硫酸铵跨膜梯度的药物负载的典型例⼦。由于脂质体核⼼的(NH4)2SO4浓度远⾼于外界介质,具有⾼渗透性和⾟醇-缓冲分配系数的DOX-NH2中性分⼦通过脂质双分⼦层扩散,具有纤维状结晶形式的(DOX-NH3)2SO4沉淀在脂质体的核⼼产⽣。(DOX-NH3)2SO4的低溶解度使脂质体内渗透压降⾄比较低,从⽽保持脂质体的完整性。对于Myocet产品临床使⽤前先加载DOX。跨膜pH梯度是DOX加载的驱动⼒。Myocet在⼀个包装中有三瓶,包括1号瓶::阿霉素HCl红⾊冻⼲粉;2号瓶:脂质体悬浮液溶于pH4-5300mM 柠檬酸中;3号瓶:碳酸钠缓冲液。临床使⽤前将空脂质体(2号瓶)注射到碳酸钠缓冲液(3号瓶)中,调节外脂质体介质pH值为7-8,然后与DOX⽣理盐⽔溶液混合。脂质体介质中中性形式的DOX分⼦(pKa=8.3)穿过脂质体双分⼦层,在囊泡内部形成独特的DOX-柠檬酸复合物。DOX-柠檬酸盐复合物呈现成束的柔性纤维,归因于DOX单体具有相对平坦的环形堆叠在⼀起形成纤维,负载效率可达95%以上。
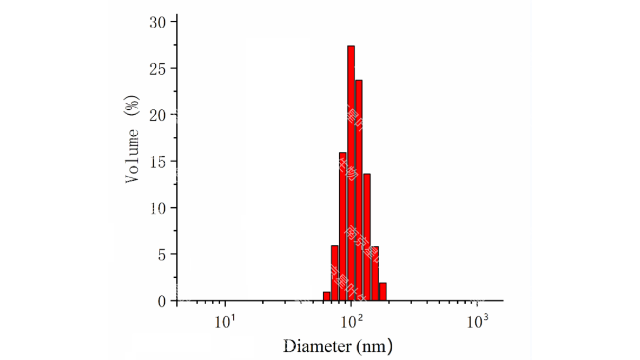
阳离子脂质体工程系统新脂质的工程化已经被研究作为一种提高核酸递送效率的手段。例如,研究人员合成了胆固醇衍生物阳离子脂质DMHAPC-Chol,并表明其可促进血管内皮生长因子(VEGF)特异性sirna进入肿瘤细胞。在结构上,脂质在其极性氨基头部分具有可生物降解的氨基甲酰基连接剂和羟基乙基。由DMHAPC-Chol和DOPE等摩尔比例组成的阳离子脂质体将VEGFsiRNA传递到A431和MDA-MB-231细胞,并显示出>90%的VEGF蛋白表达的有效沉默。在另一项研究中,开发了一种基于胆固醇的多阳离子脂质体制剂,其中精胺的亲水部分与一个或两个胆固醇残基偶联,用于递送siRNA。由合成的多阳离子脂质和DOPE组成的脂质体可抑制表达EGFP的HEK293细胞中增强的绿色荧光蛋白(EGFP)的表达。除了胆固醇衍生物,基于精氨酸的阳离子脂质也被研究用于siRNA的递送。研究人员合成了由聚l-精氨酸-9偶联聚乙二醇脂质、DOTAP、DOPE和胆固醇组成的聚l-精氨酸脂质衍生物,以增强siRNA的递送。脂质体的粒径和粒径分布的检测。
脂质体成功降低了绿色荧光蛋白(GFP)的表达,并在H4II-E和HepG2细胞中显示出较低的细胞毒性。在其他研究中,精氨酸衍生物N,N-distearyl-N-methyl-N-2-(N’-arginyl)aminoethylammoniumchloride被用于阳离子脂质体与胆固醇的配制。将这些离子脂质体与c-MycsiRNA络合,并静脉注射给B16F10黑色素瘤小鼠(1.2mg/kg,每天1次,连续3天),导致B16F10**对紫杉醇增敏。另一项研究建议使用精氨酸基DiLA2脂质作为载脂蛋白b特异性siRNA递送的阳离子脂质体组分。经小鼠静脉给药(ED50,0.1mg/kg)后,DiLA2和DOPE制备的阳离子脂质体显示出抑制肝脏载脂蛋白BmRNA表达的潜力。单次全身给药后,在给药后第2天观察到目标mRNA水平的比较大减少(约80%),并且目标mRNA的减少持续到给药后第9天。递送核酸的脂质体中的脂质成分有阳离子脂质、助脂、胆固醇结合DSPE-PGE2000等。合成脂质体载药血管
脂质体的靶向释放对吸收、分布和消除等各种药动学参数的影响。合成脂质体载药血管
脂质体靶向递送中RGD配体修饰尽管阳离子脂质体具有在体内递送核酸的潜力,但其递送到特定靶点仍然是一个主要挑战。为了增强携带核酸的阳离子脂质体在靶组织中的分布,研究人员用多肽和小分子修饰了脂质体表面。例如,研究了Arg-Gly-Asp(RGD)肽修饰的脂质体增强核酸向整合素受体表达细胞传递的能力。负载P糖蛋白特异性siRNA的RGD修饰阳离子脂质体对整合素受体表达的人乳腺*MCF7/A细胞的递送率更高,导致P糖蛋白的***沉默。与此一致的是,分子成像显示,与小鼠模型的邻近正常组织相比,MCF7/A**组织中RGD修饰的阳离子脂质体和siRNA的分布更高。在**近的一项研究中,用环RGD和辛精氨酸修饰脂质体表面,以利用环RGD的整合素受体结合效应和辛精氨酸的细胞穿透效应。双配体修饰的阳离子脂质体增加了整合素avb3表达细胞的细胞摄取,并且更有效地转染荧光素酶编码质粒DNA。合成脂质体载药血管