心血管疾病实验动物模型,英瀚斯生物小编为您介绍:1)动脉性粥样硬化动物模型常选用兔、猪、大鼠、鸡、鸽、猴和狗等。常用的方法有高胆固醇、高脂肪饲料法,免疫学法、儿茶酚胺药物注射法等。兔的优点为敏感性高,容易造成模型,时间短,缺点为它的脂质代谢与人类不同,兔表现为血源性泡沫细胞增多,解剖分布以胸动脉为主,小动脉常有病变。猪与人类相似,结合胸X-线照射,可引起冠状动脉痉挛。2)心肌缺血和心肌梗死电刺激法,雄兔麻醉后,用弱、强电交替刺激(0.8-1.6mA及4-6mA)右侧下丘脑背侧核,即可形成心肌缺血模型;药物法,给大鼠或兔注射异丙肾上腺素,狗静脉注射麦角新碱复制冠状动脉痉挛;冠状动脉阻断法,用大鼠或狗麻醉,在冠状动脉套上压迫环,复制心肌缺血和心梗模型。3)高血ya疾病动物模型可采用肾包扎法及肾动脉缩窄法复制继发性高血ya,用噪声刺激复制神经性高血ya模型。英瀚斯生物,专业技术团队,熟练掌握各类实验动物模型构建。青海推荐实验动物模型实验

新一代AD(阿尔兹海默症)实验动物模型。尽管APP-Tg小鼠在过去十几年中范围广的被用于开发新的AD医疗策略,但这种小鼠的基因表型和AD患者的还是不同。而且上述的转基因动物模型在Aβ的生成、tau蛋白的过度磷酸化、神经纤维缠结等病理特征上和AD患者的差异也很大,无法理想地模拟AD患者。为了克服这些不希望出现的问题,研究人员构建了带有Swedish(KM670/671NL)、Beyreuther/Iberian(I716F)和Arctic突变等APP基因敲入(APP-KI)小鼠。APP-KI小鼠在没有过度表达APP的情况下生成Aβ42。随着年龄的增长,APP-KI小鼠大脑皮层和海马区出现过多的Aβ沉积。另一方面,与其他AD模型一样,该模型没有tau病理、NFTs、神经退行性变或大量神经元丢失可用于研究临床前AD。由于基因组编辑的新的进展,尤其是CRISPR/Cas技术,未来对转基因动物模型进行改良也值得期待。陕西常见实验动物模型制作方法英瀚斯生物,真实做实验动物模型,可实地参观考察。
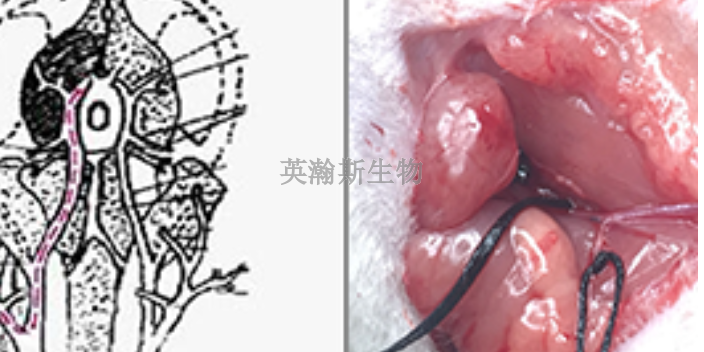
5XFAD转基因实验动物模型。5XFAD小鼠在小鼠Thy1.2启动子的控制下过度表达人类APP和PSEN1蛋白,共有5个AD连锁突变,分别是APP中的瑞典(K670N/M671L)、佛罗里达(I716V)和伦敦(V717I)突变,以及PSEN1中的M146L和L286V突变。1.5个月大的5XFAD小鼠就开始出现Aβ沉积。5XFAD小鼠在大脑中积累的Aβ42多于Aβ40,这表明5个FAD突变累积影响Aβ42的产生。然而,在5XFAD小鼠中未观察到tau过度磷酸化和NFTs的形成。2个月大时出现星形胶质细胞增生和小胶质细胞增生,表明神经炎症发生在该模型早期。5XFAD小鼠再现了人类AD的病理学,类似于Tg2576、APP23和APPPS1模型。
实验动物模型之炎症性肠病模型。炎症性肠病是基因、免疫、饮食、环境等多种因素参与的一种慢性疾病,随着现代的生活方式的改变,炎症性肠病已经越来越普遍,炎症性肠病简单的可以分为溃疡性结肠炎(UC)和克罗恩病(CD)两种,其致残率和致死率呈现持续的上升趋势。为了研究相对应的医疗药物,迄今为止科学研究者已经开发出60多种动物模型,主要可以分为以下几类:化学诱导模型(急性炎症模型,慢性炎症模型),转基因动物模型,自发性疾病模型。英瀚斯生物专业做实验外包服务,一站式医学科研平台。关于实验动物模型的重要知识点!
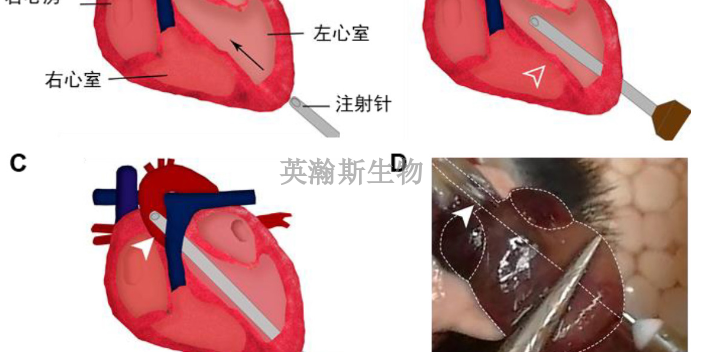
一型糖尿病实验动物模型构建:
胰腺中的胰岛β细胞变性和坏死,分泌的胰岛素不足。
诱导方法一:STZ诱导糖尿病模型。注射前用0.05mol/L柠檬酸(pH4.5)配成2%的STZ溶液,新鲜使用。大鼠糖尿病STZ的剂量为40~75mg/kg(静脉注射或腹腔注射)。小鼠对此药敏感性较差,常用量为100~200mg/kg(静脉注射或腹腔注射)。
诱导方法二:四氧嘧啶糖尿病动物模型四氧嘧啶糖一次腹腔注射150~200mg/kg或静脉注射40~100mg/kg。用药后2~3小时后出现初期高糖,持续6~12小时后进入低血糖期,动物出现痉挛,24小时后一般为持续性高糖期,β细胞呈现不可逆性坏死,发生糖尿病。
英瀚斯生物专业承接动物模型,欢迎实地考察,来电咨询。 有推荐的实验动物模型供应商吗?内蒙古专业实验动物模型是什么
实验动物模型有哪些?青海推荐实验动物模型实验
蛛网膜下腔出血系由脑底或脑表部位的血管破裂,血液破入蛛网膜下腔引起。颅内动脉瘤,脑动、静脉畸形,血压高动脉硬化等为常见病因。蛛网膜下腔出血后可引起脑血管痉挛。因此,蛛网膜下腔出血和迟发性脑血管痉挛的模型有许多共同之处,造模时可同时作为参考。
英瀚斯熟练掌握蛛网膜下腔出血造模,及其他动物模型。
复制方法 :健康大鼠,雌雄不拘,体重为250~350g。将钓鱼线剪成长约50mm,并在18mm处作标记,酒精消毒后置于无菌生理盐水中备用。麻醉后仰卧固定,剃除颈部毛发,手术区域皮肤消毒。颈正中切口,分离右侧颈总动脉、颈外动脉、颈内动脉,结扎、切断颈外动脉分支及颈总动脉分叉处小动脉,并游离颈外动脉主干,沿着颈内动脉暴露翼腭动脉,在颈外动脉残端放一丝线,使其呈一松结。在翼腭动脉起始部置一微动脉夹,同时夹闭颈总动脉及颈内动脉主干近端。在颈外动脉残端剪一小口,将制备好的栓线插入。此时将颈外动脉残端处丝线的松结拉紧,除去颈内动脉的动脉夹,继续将丝线沿着颈内动脉插入,直至感到有阻力,这时稍用力再插入1.0~1.5mm后有落空感即可抽出丝线并除去微动脉夹。栓线的直径及插入的深度根据动物的体重而定。 青海推荐实验动物模型实验