HE染色组织样本水化:将浸泡过二甲苯的待测组织样本先放入无水乙醇中浸泡5min,使脱蜡时用的二甲苯可以被洗脱出去,使水可以进入组织中;再依次置于95%、85%、70%乙醇中各浸泡5min以达到充分水化的效果。组织切片苏木素染色、分化与反蓝:将水化后的组织样本的切片使用PBS溶液浸泡清洗,每次浸泡5min,总共清洗3次。之后用移液***吸取已经预先配制好的苏木素染色液,每个组织切片滴加100ul,充分染色10min。染色完毕后使用蒸馏水洗去多余的苏木素染色液。然后再使用1%的盐酸乙醇进行分化,使细胞核中结合过多的染液和细胞浆中的多余的染液被除去。分化完成后,再用双蒸水将组织切片冲洗干净。为了使苏木素染蓝色,使用弱碱性的促蓝液加入组织切片中,让细胞核染蓝色。反蓝结束后先用清水进行清洗,再用双蒸水将组织切片冲洗干净。HE染色是常见的病理染色,是比较基础是病理染色之一。山西推荐的HE染色

HE染色是苏木精 — 伊红染色法 ( hematoxylin-eosin staining ) ,简称HE染色法 ,石蜡切片技术里常用的染色法之一 。苏木精染液为碱性 ,主要使细胞核内的染色质与胞质内的核酸着紫蓝色 ;伊红为酸性染料 ,主要使细胞质和细胞外基质中的成分着红色 。HE染色法是组织学、胚胎学、病理学教学与科研中**基本、使用*****的技术方法。由于组织或细胞的不同成分对苏木精的亲和力不同及染色性质不一样。经苏木精染色后,细胞核及钙盐粘液等呈蓝色,可用盐酸酒精分化和弱碱性溶液显蓝,如处理适宜,可使细胞核着清楚的深蓝色,胞浆等其它成分脱色。再利用胞浆染料伊红染胞浆,使胞浆的各种不同成分又呈现出深浅不同的粉红色。故各种组织或细胞成分与病变的一般形态结构特点均可显示出来。江苏靠谱的HE染色多少钱冰冻切片是否可以做HE染色?
HE染色脱蜡不净的原因及验证方法:1)二甲苯使用过久,含蜡成分太高或脱蜡效果差:可更换二甲苯验证。2)切片经烤片,冷却后放入二甲苯脱蜡或室温太低;延长拖拉时间或用热的切片脱蜡验证。3)脱蜡时间太短或振荡太少,幅度太小;可延长脱蜡时间或以多振荡来验证。4)洗涤二甲苯用的乙醇使用时间过久,导致乙醇中二甲苯含量过高,二甲苯残留在切片上(由于二甲苯与水不相溶,切片上有二甲苯的地方,苏木精就没有办法渗透进去,在切片染色完成后留下了点状的不着**域):更换各道乙醇验证。5)二甲苯、乙醇质量不佳(偶有试剂瓶内装的试剂与试剂名不相符):换批号验证。6)更换脱蜡液体时试剂拿错:需重新配置验证。7)更换脱蜡液体时试剂次序放错:需重新配置验证。8)烤片时间短,切片上水分没有烤干,也会导致着色不匀,出现点状发白区域。
HE染色常见问题:Q3:细胞核染色过浅,颜色暗淡答:切片在苏木素染液中停留过短,或苏木素过度氧化失效,或分化时间太长。对策:重新染色。将组织切片放入0.01%氢氧化钠、0.5%氨水、饱和的碳酸氢钠溶液、乙醇溶液,每个3-5min即可,接着重新染色。可以适当地组织的嗜碱性以增强核染色,如Zenker液固定的切片可放入5%碳酸氢钠溶液中3h,自来水冲洗5-10min染色,或Bouin液固定的切片可放入5%碳酸氢钠溶液中1h,自来水冲洗10min染色。Q4:细胞核染色过深,胞浆着蓝色答:切片在苏木素染液中停留过长;或切片太厚;或分化时间太短。这种情况首先镜下看看切片厚度(比较好厚度1-2层细胞核),要么重新染色,要么重新制片。南京英瀚斯,专业的病理染色实验服务平台。HE染色过程中常见的问题以及应对方法。
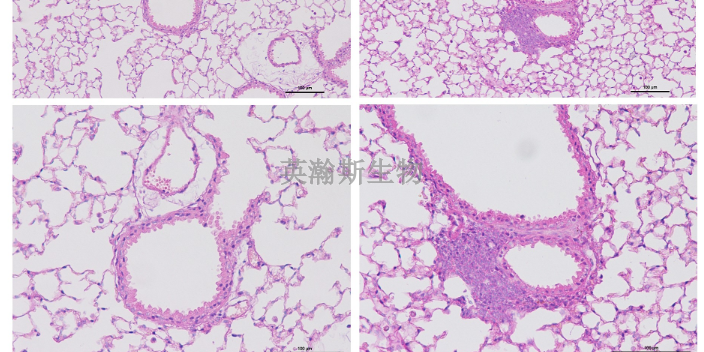
HE染色伊红着色淡分析及应对原因:(1)伊红染液的pH值可能大于5;(2)蓝化液残留过多;(3)切片太薄;(4)切片经伊红染色后在乙醇脱水时间过长。对策:检查伊红染液的pH值,如果必要的话,用乙酸将其调节在4~5之间,从而使伊红染色彩艳丽。确保每次蓝化步骤完成后,使用的弱碱性溶液被充分洗去,玻片上没有残留的弱碱性溶液。检查切片的厚度。脱水时不要让切片在低浓度乙醇停留时间过长,因为含水多的低浓度乙醇会将伊红的颜色分化掉。HE染色的基本原理和结果分析。江苏结果客观的HE染色哪家好
常用HE染色试剂配制方法。山西推荐的HE染色
HE染色细胞核被苏木精染成鲜明的蓝色,软骨基质、钙盐颗粒呈深蓝色,粘液呈灰蓝色。细胞浆被伊红染成深浅不同的粉红色至桃红色,胞浆内嗜酸性颗粒呈反光强的鲜红色。胶原纤维呈淡粉红色,弹力纤维呈亮粉红色,红血球呈橘红色,蛋白性液体呈粉红色。着***况与组织或细胞的种类有关,也随其生活周期及病理变化而改变。例如,细胞在新生时期胞浆对伊红着色较淡或轻度嗜碱,当其衰老时或发生退行性变则呈现嗜伊红浓染。胶原纤维在老化和出现透明变性时,伊红着色由浅变深。山西推荐的HE染色