无细胞蛋白表达技术(CFPS)正在彻底改变合成生物学、生物技术和药物开发等关键领域,它通过突破传统大肠杆菌(E. coli)等细胞表达系统的固有局限,实现了三大he xin优势:更快的生产周期更灵活的合成条件调控;可表达毒性蛋白或体内难以合成的复杂结构蛋白;这使得CFPS成为zhi liao性蛋白开发、功能基因组学和高通量蛋白质筛选不可或缺的工具。由于摆脱了细胞代谢的束缚,CFPS可实时优化反应条件,从而明显提升蛋白产量并优化生产效率。小麦胚芽裂解物则凭借低核酸酶活性成为长期反应(>24小时)的理想选择。外源蛋白表达发展前景
体外蛋白表达正在革新现场快速检测技术。以疟疾诊断为例:将冻干的大肠杆菌裂解物、疟原虫 HRP2 基因 DNA 及显色底物预装在微流控芯片中,加入水样后启动 30 分钟体外蛋白表达反应,生成的 HRP2 蛋白催化显色剂变红,灵敏度达 5 寄生虫/μL(传统试纸只 200/μL)。此方案在刚果金野外测试中显示,阳性检出率提升 40% 且无需冷链运输。类似技术已扩展至COVID-19检测——用患者鼻拭子 RNA 直接合成 Spike 蛋白,结合纳米金抗体实现 1 小时确诊。这种 “即测即表达”模式 将诊断成本降至 $0.5/次,成为资源匮乏地区的抗疫利器。外源蛋白表达载体构建自供能体外蛋白表达系统是构建人工细胞的重要路径。

体外蛋白表达技术的重点在于利用细胞裂解物中的生物合成机器(核糖体、tRNA、翻译因子)在试管中直接合成蛋白质。以大肠杆菌系统为例:首先制备含T7启动子的线性DNA模板,将其与商业化裂解物(如RocheRTS100)、能量混合物(ATP/GTP)及20种氨基酸混合,在37℃振荡反应2-4小时即可完成蛋白表达。整个过程无需细胞培养与基因转染,速度比传统方法快10倍以上。例如,COVID19刺突蛋白RBD结构域的体外表达只需6小时,而HEK293细胞系统需5天。该技术的关键优势是开放体系的可编程性——可直接添加非天然氨基酸(如Azidohomoalanine)合成定制化蛋白,为药物偶联物开发提供高效平台。
在中国,无细胞蛋白表达技术(CFPS)的推广面临he xin原料依赖进口的挑战。商业化裂解物、高效能量再生系统等关键试剂仍以Thermo Fisher、Merck等国际品牌为主,国产替代品在活性和稳定性上存在差距,导致成本居高不下。此外,无细胞蛋白表达技术工艺的规模化放大技术尚未成熟,反应体系均一性、产物收率等问题限制了其在GMP生产中的应用。尽管国内科研机构(如中科院、清华大学)在基础研究上取得突破,但产学研转化效率较低,缺乏类似Synthelis的专注无细胞蛋白表达技术的本土企业,难以形成完整的产业链条。体外蛋白表达技术正在改写蛋白质研究的时空规则。

20世纪90年代后,随着分子生物学和合成生物学的进步,无细胞蛋白表达技术技术迎来突破。研究者通过优化裂解物制备(如敲除大肠杆菌核酸酶)、开发能量再生系统(如Phosphoenolpyruvic acid,PEP循环),明显提升蛋白产量和反应时长。2000年代初,连续交换式反应体系(CECF)的出现解决了底物耗尽问题,使反应时间延长至24小时以上,产量达毫克级,为工业化铺平道路。此阶段,无细胞蛋白表达技术开始应用于毒性蛋白合成和抗体片段生产,但成本仍较高。兔网织红细胞裂解物含成熟血红蛋白合成机制,能实现复杂酶活性分子的功能性蛋白表达。目的蛋白表达下调
大肠杆菌裂解物的高翻译效率可支持100μg/mL级蛋白产量,限制造就完整功能的真**白表达。外源蛋白表达发展前景
相较于传统细胞表达系统,体外蛋白表达的he xin优势在于:时间效率ge min性提升: 省略细胞培养与基因整合步骤,目标蛋白可在2-8小时内合成;开放体系可编程性: 直接添加非天然氨基酸、同位素标记底物或荧光基团,实现对产物化学性质的准确调控;毒性蛋白表达可行性: 无细胞环境避免毒性蛋白导致的宿主死亡,为凋亡因子等特殊分子研究提供可能;微型化兼容性: 反应体积可缩小至纳升级,适配高通量筛选需求。这些特性使体外蛋白表达成为 功能蛋白快速验证的推荐平台,尤其在需平行测试多突变体的场景中具明显优势。外源蛋白表达发展前景
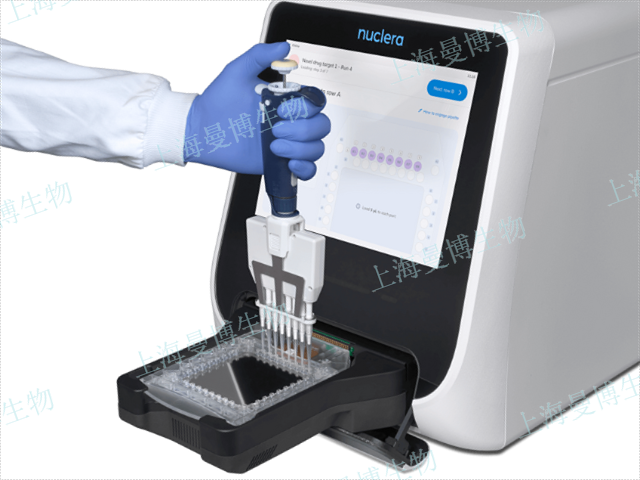
nuclera 高通量微流控蛋白表达筛选eProtein Discovery系统 1、从D...
【详情】提升体外蛋白表达效能的关键技术路径包括:裂解物工程化改造: CRISPR敲除核酸酶/蛋白酶基因增强稳...
【详情】eProtein Discovery系统:一种将无细胞蛋白合成与数字微流控相结合的快速蛋白质原型...
【详情】无细胞蛋白表达技术(CFPS)正在彻底改变合成生物学、生物技术和药物开发等关键领域,它通过突破传统大...
【详情】