为了验证动物生物样品的时间分辨成像能力,本实验观察了活海拉细胞高尔基体中的青色荧光蛋白mTFP1,见图3(a),(c)-(i)。使用的物镜及尺寸与荧光颗粒成像一致,对比可见v2PE在空间分辨率、激发深度级图像对比度较常规宽场显微镜都有所提高。此外,v2PE可以同时激发多个波长的荧光蛋白,这种技术还可以应用于细胞内分子的三维动力学多色成像。在此基础上,实验对海拉细胞中的高尔基体(mTFP1)和纤颤蛋白(EGFP)进行了在体成像,见图3(j)-(n),青色为mTFP1,绿色为EGFP,实验中两种荧光蛋白同时成像,终采用光谱分离法将不同蛋白的荧光信号分离出来。双光子显微镜在组织透明化成像中应用。美国ultimainvestigator双光子显微镜光毒性

有了双光子激发技术,激光共聚扫描显微镜可以发挥更好的作用。那么,什么是双光子激发技术呢?在光子密度较高的情况下,荧光分子可以同时吸收两个波长较长的光子,使电子跃迁到更高的能级。短时间后,电子跳回到较低的能级,发出波长为长波长一半的光子(P=h/λ)。利用这个原理,双光子激发技术诞生了。双光子显微镜使用长波长脉冲激光通过物镜会聚。由于双光子激发需要很高的光子密度,物镜焦点处的光子密度比较高,所以双光子激发只能发生在焦点处产生荧光,该点产生的荧光穿过物镜,被光学探头接收,从而达到逐点扫描的效果。国内bruker双光子显微镜的原理双光子显微镜已成为较厚有生命体生物组织三维成像中不可或缺的工具。
而配合了双光子激发技术,激光共聚扫描显微镜则能更好得发挥功效。那么,什么是双光子激发技术呢?在高光子密度的情况下,荧光分子可以同时吸收2个长波长的光子使电子跃迁到较高能级,经过一个很短的时间后,电子再跃迁回低能级同时放出一个波长为长波长一半的光子(P=h/λ)。利用这个原理,便诞生了双光子激发技术。双光子显微镜使用长波长脉冲激光,通过物镜汇聚,由于双光子激发需要很高的光子密度,而物镜焦点处的光子密度是比较高的,所以只有在焦点处才能发生双光子激发,产生荧光,该点产生的荧光再穿过物镜,被光探头接收,从而达到逐点扫描的效果。
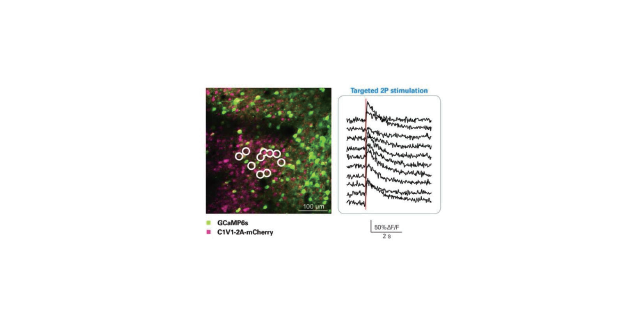
双光子荧光显微镜是结合了激光扫描共聚焦显微镜和双光子激发技术的一种新技术。双光子激发的基本原理是:在高光子密度的情况下,荧光分子可以同时吸收2个长波长的光子,在经过一个很短的所谓激发态寿命的时间后,发射出一个波长较短的光子;其效果和使用一个波长为长波长一半的光子去激发荧光分子是相同的。双(多)光子成像优势在于,具有更深的组织穿透深度,利用红外光,能够在层面检测极限达1mm的组织区域;因信号背景比高,而具有更高的对比度;因激发体积小,具有定点激发的特性,具有更少的光毒性;激发波长由紫外、可见光调整为红外激发,使其能够更加安全。双光子显微镜观察到的现象证明了钙离子的增加依赖于肌体触发的钠离子作用电势。

随着技术的发展,双光子显微镜的性能得到不断地优化,结合它的特点,大致可以分成深和活两个方面的提升。要想让激发激光进入更深的层面,大致可从两个方面入手,装置优化与标本改造。关于装置优化,我们可以把激光束变得更细,使能量更加集中,就能让激光穿透更深。关于标本,其中影响光传播的主要是物质吸收和散射,解决这个问题,我们需要对样本进行透明化处理。一种方法是运用某种物质将标本浸泡,使其中的物质(主要是脂质)被破坏或溶解。另一种方法是运用电泳将脂质电解,让标本的“透明度”提高。双光子显微镜角膜成像。美国ultimainvestigator双光子显微镜光毒性
双光子显微镜使用高能量锁模脉冲器。美国ultimainvestigator双光子显微镜光毒性
双光子显微镜是一种先进的成像技术,能够实现细胞或组织的深层观察。它的主要特点是使用双光子激发来产生荧光,从而实现对生物样品的高分辨率成像。双光子显微镜的工作原理是利用激光的脉冲宽度极窄的特性,将高能激光束聚焦到生物样品中,激发出荧光。这个过程需要使用一个特殊的双光子激发源,它能够将一个光子转换为两个光子,其中一个光子用于激发荧光,另一个光子则用于成像。双光子显微镜具有以下优点:高分辨率:由于双光子激发的特性,可以实现对生物样品的高分辨率成像,特别是对于深层组织的观察。穿透深度大:双光子激光的波长较长,能够更好地穿透生物组织,从而实现对深层细胞的观察。荧光寿命长:双光子激发产生的荧光寿命比单光子激发产生的荧光寿命长,这使得双光子显微镜能够更好地区分不同的荧光标记物。减少光毒性:由于双光子激发的能量较低,因此对生物样品的损伤较小,可以减少光毒性。总之,双光子显微镜是一种非常有用的成像技术,可以用于生物学、医学、材料科学等领域的研究。美国ultimainvestigator双光子显微镜光毒性