双光子吸收理论早在1931年就由诺奖得主MariaGoeppertMayer提出,30年后因为有了激光才得到实验验证,但是到WinfriedDenk发明双光子显微镜又用了将近30年。要理解双光子的技术挑战和飞秒激光发挥的重要作用,首先要了解其中的非线性过程。双光子吸收相当于和频产生非线性过程,这要求极高的电场强度,而电场取决于聚焦光斑大小和激光脉宽。聚焦光斑越小,脉宽越窄,双光子吸收效率越高。对于衍射极限显微镜,聚焦在样品上的光斑大小只和物镜NA和激光波长有关,所以关键变量只剩下激光脉宽。基于以上分析,能够以高重频(100MHz)输出超短脉冲(100fs量级)的飞秒激光器成了双光子显微镜的标准激发光源。这也再次说明双光子显微镜的优势:只有焦平面处才能形成双光子吸收,而焦平面之外由于光强低无法被激发,所以双光子成像更清晰。WinfriedDenk初使用的光源是染料飞秒激光器(100fs脉宽、630nm可见光波长)。虽然染料激光器对于实验室演示尚可,但是使用很不方便所以远未实现商用。很快双光子显微镜的标配光源就变成了飞秒钛宝石激光器。除了固态光源优势,钛宝石激光器还具有较宽的近红外波长调谐范围,而近红外相比可见光穿透更深,对生物样品损伤更小。上海双光子显微镜就找因斯蔻浦。进口investigator双光子显微镜光损伤
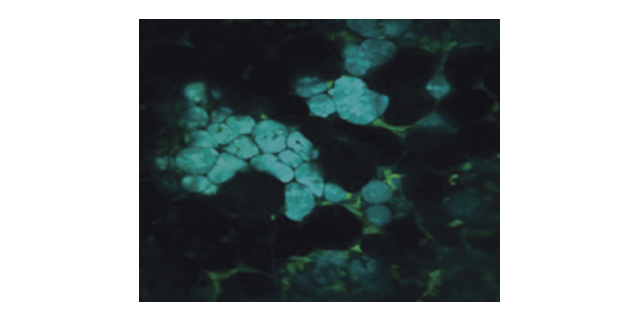
掺杂可以明显影响碳点(CDs)的发射和激发特性,使双光子碳点(TP-CDs)具有本征双光子激发特性和605nm的红光发射特性。在638nm激光照射下,除了长波激发和发射外,还可以实现活性氧(ROS)的产生,这为光动力技术提供了巨大的可能性。更重要的是,通过各种表征和理论模拟证实,掺杂诱导的N杂环在TP-CDs与RNA的亲和力中起关键作用。这种亲和力不仅为实现核仁特异性自我靶向提供了可能,而且通过ROS断裂RNA链解离TP-CDs@RNA复合物,赋予治疗过程中的荧光变异。TP-CDs结合了ROS的产生能力、光动力疗法(PDT)过程中的荧光变化、长波激发和发射特性以及核仁的特异性自靶向性,可以认为是一种结合核仁动态变化实时处理的智能CDs。美国激光荧光双光子显微镜厂家有哪些双光子显微镜不需要共聚焦细孔,提高了荧光检测效率。

配合双光子激发技术,激光共聚扫描显微镜则能更好得发挥功效。那么,什么是双光子激发技术呢?在高光子密度的情况下,荧光分子可以同时吸收2个长波长的光子使电子跃迁到较高能级,经过一个很短的时间后,电子再跃迁回低能级同时放出一个波长为长波长一半的光子(P=h/λ)。利用这个原理,便诞生了双光子激发技术。双光子显微镜使用长波长脉冲激光,通过物镜汇聚,由于双光子激发需要很高的光子密度,而物镜焦点处的光子密度是比较高的,所以只有在焦点处才能发生双光子激发,产生荧光,该点产生的荧光再次穿过物镜,被光探头接收,从而达到逐点扫描的效果。
在高光子密度的情况下,荧光分子可以同时吸收两个长波长的光子,然后发射出一个波长较短的光子,其效果和使用一个波长为长波长一半的光子去激发荧光分子是相同的如烟酰胺腺嘌呤二核苷酸(NADH),在单光子激发时,在波长为350nm光的激发下发出450nm荧光;而在双光子激发时,可采用700nm的激发光得到450nm荧光。由于双光子激发需要很高的光子密度,为了不损伤细胞,双光子显微镜使用高能量锁模脉冲激光器。这种激光器发出的激光具有很高的峰值能量和很低的平均能量,从而可以减少光漂白和光毒性带来的不利影响。双光子显微镜使用长波长脉冲光,是通过物镜汇聚的。

指示剂是如何负载细胞,目前有三种在神经元上填充钙离子指示剂的方法,且都可以用于体内和体外研究。第一种方法是利用玻璃吸管将膜渗透性盐或葡聚糖形式的指示剂注入单个神经元中。此方法方便实验者控制单个神经元内的钙离子指示剂浓度且信噪比较高。第二种是利用“批量加载”的方法将钙离子指示剂染料负载神经元,观察对象为一群神经元。尽管此方法可能导致一些胶质细胞也被指示剂所标记,但明显提高了整体神经元的标记百分比,使研究者得以观察到一群神经元内动作电位相关性的活动。第三种也较为常用,通过病毒转染的方式使其基因编码钙离子指示剂。(A)单细胞注射法;(B)networkloading法;(C)通过病毒转染使其基因编码钙离子指示剂(expressionofgeneticallyencodedcalciumindicators,GECI)双光子显微镜只有焦平面处才能形成双光子吸收,而焦平面之外由于光强低无法被发动,所以双光子成像更清晰。investigator双光子显微镜分辨率
双光子显微镜已成为较厚有生命体生物组织三维成像中不可或缺的工具。进口investigator双光子显微镜光损伤
n掺杂可以明显影响碳点(CDs)的发射和激发特性,使双光子碳点(TP-CDs)具有本征双光子激发特性和605nm红光发射特性。在638nm激光的照射下,除了长波激发和发射外,还能产生活性氧,这为光动力技术提供了极大的可能性。更重要的是,各种表征和理论模拟证实了掺杂诱导的N杂环在TP-CDs与RNA的亲和力中起着关键作用。这种亲和力不仅可以实现核仁特异性的自我靶向,还可以通过ROS断裂RNA链来解离TP-CDs@RNA复合物,从而在治疗过程中产生荧光变化。TP-CDs结合了ROS产生的能力、PDT过程中的荧光变化、长波激发和发射特性以及核仁特异性自靶向性,因此可以认为是一种实时处理核仁动态变化的智能CDs。进口investigator双光子显微镜光损伤