单光子显微技术是成熟的荧光显微技术,但由于其使用的激发光波长较短,成像深度有限;能量较大,会造成对荧光物质的漂白,光毒性严重。激光共焦扫描显微镜由于共焦显微镜的孔径很小,实现样本三维成像要逐点扫描,成像速度慢,对样本损害大,很难用于长时间活细胞成像。而宽场显微镜能够很好地实现实时动态成像,光漂白小,因而较早应用于活细胞内的实时检测,但宽场显微镜由于离焦信号的干扰,难以实现多维成像。双光子荧光显微镜(Two-PhotonLaser-ScanningMicroscopy)。双光子显微成像技术是近些年发展起来的结合了共聚焦激光扫描显微镜和双光子激发技术的一种新型非线性光学成像方法,采用长波激发,能对组织进行深层次成像。常用的比较好激发波长大多位于800-900nm,而水、血液和固有组织发色团对这个波段的光吸收率低,此外散射的激发光子不能激发样品,因此背景第,光损伤小,适用于在体检测。双光子荧光成像技术能准确定位细胞内置入的微电极位置,从而观察胞体、树突甚至单个树突棘的活性。研究者可完整的观察神经组织的分辨荧光图像,甚至可以分辨神经细胞单个树突棘中的钙分布。双光子显微镜是新型的荧光显微镜,其原理大致是这样的;国外荧光激光双光子显微镜成像视野一般是多少
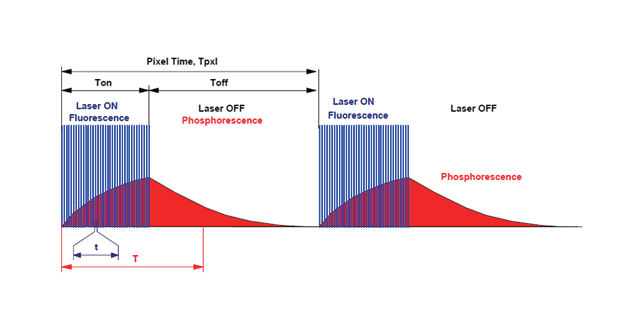
双光子显微镜的优势:在深度组织中以较长时间对活细胞成像,双光子显微镜是当前之选。双光子和共聚焦显微镜都是通过激光激发样品中的荧光标记,使用探测器测量被激发的荧光。但是,共聚焦一般使用单模光纤耦合激光器,通过单光子激发荧光,而双光子使用飞秒激光器,通过几乎同时吸收两个长波光子激发荧光。下面是两种技术的对比图。双光子激发荧光的主要优势:双光子比共聚焦使用的更长的波长,所以对组织的损伤更小且穿透更深。共聚焦的成像深度一般为100微米,双光子则能达到250到500微米,甚至超过1毫米。另外,同时吸收两个光子意味只有度聚焦点处能被激发,所以不会损伤焦平面之外的组织,并且生成更清晰的图像。国外双光子显微镜的原理双光子显微镜在组织透明化成像中应用;
双光子显微成像技术不是什么新技术,早在20多年前就有了,目前已经在生命科学和材料科学中广泛应用。几年前双光子**过期后,已经推出自己的双光子显微镜的厂家估计不少于10家以上。即便如此,世界上很多实验室都搭双光子,自己搭的好处有很多,首先是便宜,尤其是实验室已经有飞秒激光器,那就更很省钱了。其次是灵活,可以选择针对特殊用途的搭配,改动也灵活。结束后的好处就是可以锻炼队伍,一趟走下来可以把新手带出来,后期维护也更加自由。当然坏处也不少,首先是操心,特别是第1次搭的时候,开始要想方案,后来要解决各种实际问题。其次是花时间,加上买配件的时间,比买一台现成的商业化双光子耗时长。现在已经有不少关于如何搭双光子显微镜的文章,各种protocol,大多是老外写的,中文的较少。其实完全自己搭一套好用的系统还是不容易的,尤其是没有经验的时候,容易走弯路,多花钱,也多花时间,再加上双光子的重要器件都需要从国外购买,在国内买这些东西耗时较长。因此,我想总结一下我们的经验,贴出来分享,希望能帮到想自己动手的实验室
双光子技术在医疗诊断应用中具有巨大的潜力,该领域还未形成标准和体系,需要系统的医学研究与庞大的医疗数据加以支撑,通过研究人体基于多光子成像技术,进行细胞结构、生化成分、微环境、组织形态、代谢功能的影响信息,找到与疾病的细胞学、分子生物学、组织病理学、诊断和特征的关联关系,共同探究生理病理基础和分子细胞生物学机制,筛选鉴定、皮肤病、自身免疫病及其他疑难疾病的诊断及鉴别诊断依据,建立全新的多光子细胞诊断的完整数据库,定义出针对不同疾病的多光子临床检测设备的产品标准。讨论环节,来自病理科、呼吸中心、心脏科、神经科、皮肤科及研究所的多位医师及研究人员纷纷结合各自的工作领域与王爱民副教授展开了热烈的讨论,其中毛发中心杨顶权主任计划再次邀请王爱民副教授进行学术交流。通过本次学术交流,病理科与研究所分别与王爱民副教授课题组达成了初步合作意向。双光子显微镜使用高能量锁模脉冲器。

配合双光子激发技术,激光共聚扫描显微镜则能更好得发挥功效。那么,什么是双光子激发技术呢?在高光子密度的情况下,荧光分子可以同时吸收2个长波长的光子使电子跃迁到较高能级,经过一个很短的时间后,电子再跃迁回低能级同时放出一个波长为长波长一半的光子(P=h/λ)。利用这个原理,便诞生了双光子激发技术。双光子显微镜使用长波长脉冲激光,通过物镜汇聚,由于双光子激发需要很高的光子密度,而物镜焦点处的光子密度是比较高的,所以只有在焦点处才能发生双光子激发,产生荧光,该点产生的荧光再穿过物镜,被光探头接收,从而达到逐点扫描的效果。双光子显微镜是结合了双光子技术和扫描共聚显微镜的一种新型荧光显微镜;进口双光子显微镜授权供应商
双光子显微镜的原理是什么?国外荧光激光双光子显微镜成像视野一般是多少
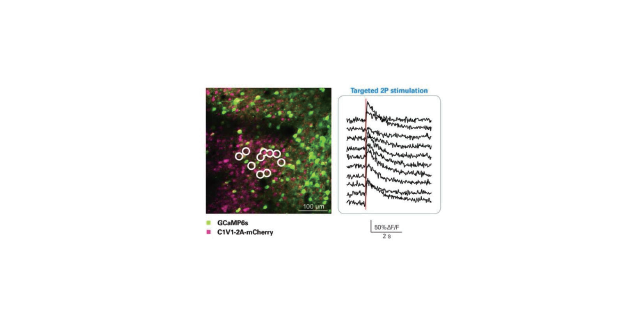
指示剂是如何负载细胞,目前有三种在神经元上填充钙离子指示剂的方法,且都可以用于体内和体外研究。第一种方法是利用玻璃吸管将膜渗透性盐或葡聚糖形式的指示剂注入单个神经元中。此方法方便实验者控制单个神经元内的钙离子指示剂浓度且信噪比较高。第二种是利用“批量加载”的方法将钙离子指示剂染料负载神经元,观察对象为一群神经元。尽管此方法可能导致一些胶质细胞也被指示剂所标记,但明显提高了整体神经元的标记百分比,使研究者得以观察到一群神经元内动作电位相关性的活动。第三种也较为常用,通过病毒转染的方式使其基因编码钙离子指示剂。(A)单细胞注射法;(B)networkloading法;(C)通过病毒转染使其基因编码钙离子指示剂(expressionofgeneticallyencodedcalciumindicators,GECI)国外荧光激光双光子显微镜成像视野一般是多少