在高光子密度的情况下,荧光分子可以同时吸收两个长波长的光子,然后发射出一个波长较短的光子,其效果和使用一个波长为长波长一半的光子去激发荧光分子是相同的如烟酰胺腺嘌呤二核苷酸(NADH),在单光子激发时,在波长为350 nm光的激发下发出450 nm荧光;而在双光子激发时,可采用700 nm的激发光得到450 nm荧光。由于双光子激发需要很高的光子密度,为了不损伤细胞,双光子显微镜使用高能量锁模脉冲激光器。这种激光器发出的激光具有很高的峰值能量和很低的平均能量,从而可以减少光漂白和光毒性带来的不利影响。双光子显微镜大量运营在实验室当中。国外荧光激光双光子显微镜应用是什么
1.生物组织对红外光的吸收弱,对可见光吸收强。类似的,平时用手电筒照射手指,会看到手通透红亮,也是由于生物组织对长波长的红光吸收少。2.生物组织对红外光的散射弱。因为瑞利散射的强度反比于波长λ的四次方。类似的,早晨的太阳非常红,也就是因为长波长的红光穿透力更强。这两点共同导致长波长的红外光比可见光对生物组织的穿透能力强。与单光子显微镜(如共聚焦显微镜)相比,双光子显微镜可以使用约二倍波长的激光去激发荧光团。长波长光束散射程度低(RayleighScattering),所以穿透能力强。bruker双光子显微镜扫描深度双光子显微镜不需要共聚焦,提高了荧光检测效率。
其实电子显微镜相比于光学显微镜的重要优势或者存在的比较大意义,准确的来说,不在于放大倍数,而在于超高的分辨率。这两者是不同的。通俗的来说,就是进行观察的时候,除了要将物体放大,还需要能将它与相邻的其他物体分辨开来。如果两个相邻微粒的图像在光学显微镜下,即使放大到很大,看到的可能却是两个相交的亮斑(艾里斑),而没有明显的界限(更不用说细节了),这表示是分辨率不够。抛开分辨率谈放大倍数是没有意义的。光学显微镜的分辨率极限是阿贝极限,约等于光波波长的一半,通常被说成是光学显微镜放大极限,其实准确地来说,应该叫做分辨率的极限。而其产生的原因是光的衍射,根本原因是光的波粒二象性。电子衍射实验证明了电子的波动性,于是用电子代替光的电子显微镜成为可能。电子显微镜也有多种,题主说的是像REM的。电镜也存在用衍射规则观察的,比如低能电子衍射(LEED)和透射电镜(TEM)。两者主要用于观察晶体,根据其周期性的特点而生成倒易空间里的衍射图像,借助elward球或者傅里叶变换就可以转换到实空间,得到真正的晶体表面图像了。
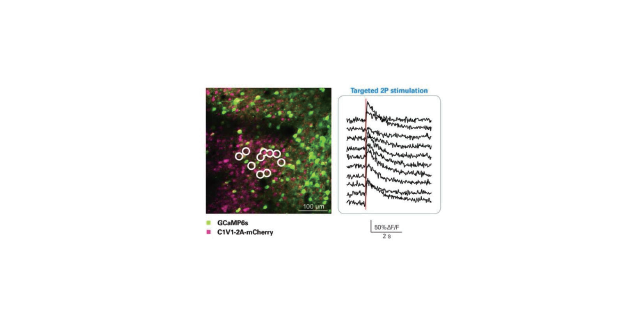
通过对微型光学系统的重新设计,FHIRM-TPM 2.0成像视野扩大至420×420平方微米,微型物镜的工作距离扩展至1毫米,以实现非侵入式成像;嵌入了可拆卸的快速轴向扫描模块,实现了180微米深度的三维体成像和多平面快速切换的实时成像。该模块由一个快速的电动变焦透镜和一对中继透镜组成,在不同深度成像时保持放大倍率恒定。其中,变焦模块重量1.8克,研究人员可根据实验需求自由拆卸。此外,新版微型化成像探头还可整体即时拔插,极大地简化了实验操作,避免了长周期实验时对动物的干扰。在重复装卸探头追踪同一批神经元时,视场旋转角小于0.07弧度,边界偏差小于35微米。双光子显微镜的应用中,该如何选择以及更好的使用PMT。

和很多伟大的科学发明一样,双光子显微镜的出现也有一点偶然,但正是那瞬间的灵感为生物科学尤其是神经科学带来了一种**性的成像技术:双光子激发荧光显微镜。1990年初,当WinfriedDenk刚从康奈尔大学博士毕业准备前往瑞士读博后时,他看了一本关于激光扫描显微镜的书,从中了解到非线性光学效应——强光和物质的相互作用。当时,Denk有同事研究生物样品中的钙离子但苦于没有强大的紫外激光器和光学元件,于是他就想到如果使用双光子吸收就能够绕开紫外,换言之,与其通过一个紫外光子激发标记的钙离子,通过两个双倍波长的可见光光子也能激发相同的荧光。双光子显微镜大量运营在实验室当中;bruker双光子显微镜最大分辨率
由于双光子显微镜使用的是可见光或近红外光作为激发光源,适用于长时间的研究。国外荧光激光双光子显微镜应用是什么
在传统宽场显微镜中,来自标本不同纵深的光线都可投射到同一焦平面(感光元件)上,所以其成像是整个样品的重叠像,没有纵向分辨能力。单光子激光共聚焦显微镜用***有效滤除了杂散光,分辨率有了本质上的提高,拥有了对样品的特定焦平面精细成像的能力,可以进行三维成像、动态成像等。然而,***在滤除杂散光的同时也将大部分来自焦平面的荧光滤除了,只有很弱的荧光到达检测器。若要提高信号强度,需要加大激发光功率,这又会导致对活细胞的光毒性和荧光分子的光漂白增加。双光子显微镜比较大的优势来源于其双光子光源的非线性光学效应,与单光子共聚焦显微镜比较大的不同在于无须使用***限制光学散射,其具体优势如下。国外荧光激光双光子显微镜应用是什么