- 产地
- 苏州
- 品牌
- 外泌体提取试剂
- 型号
- 齐全
- 是否定制
- 是
所有的细胞都能分泌外泌体,但是不同细胞分泌的外泌体不管在数量上还是在内含物中都具有很大的差异性,这也决定了每种外泌体所行使的功能不一样。外泌体普遍参与细胞间物质运输与信息传递,调控细胞生理活动。同时,外泌体具有抗原提呈、免疫逃逸、诱导正常细胞转化、促进一些病症发生和转移等作用;此外,外泌体还可以作为“天然的纳米粒子”来进行药物递送。外泌体相关数据库有哪些?lexoRBase数据库收集和描述人类血液外泌体中所有长的RNA,包括circRNA、lncRNA和mRNA。lEVpedia和Vesiclepedia数据库汇总了不同囊泡研究中发现的蛋白、mRNA、miRNA、脂类等信息。lExoCarta数据库主要收录了包括人、大鼠、小鼠、绵羊等几个物种的286个研究结果,涉及蛋白、mRNA、miRNA、脂类等信息。使用可截留100KD分子量的膜,通过离心截留上清中的外泌体,截留完成后。徐州外泌体提取试剂厂家供应
外泌体作为RNAi药物载体的疗效:这项研究,检测了利用exosomes作为RNAi靶向药物的效果,并证明了这个过程中exosomes进行免疫逃逸的机制:对exosomes进行基因修饰(命名为iExosome),装载上靶向胰腺病细胞KRAS突变基因的RNA干扰药物,在小鼠模型上进行试验,结果表明,iExosome比同样经过修饰的脂质iLiposome递送效果更好,能够压制侵袭性胰腺病生长;这得益于exosomes表面的CD47,它能够阻止exosomes在血液循环系统中被单核细胞清理。这项研究结果对致力于exosomes转化医学的科学家来说,可谓振奋人心!徐州外泌体提取试剂厂家供应专利申请利用分离培养人尿液来源细胞并收集培养基来进行体外培养。
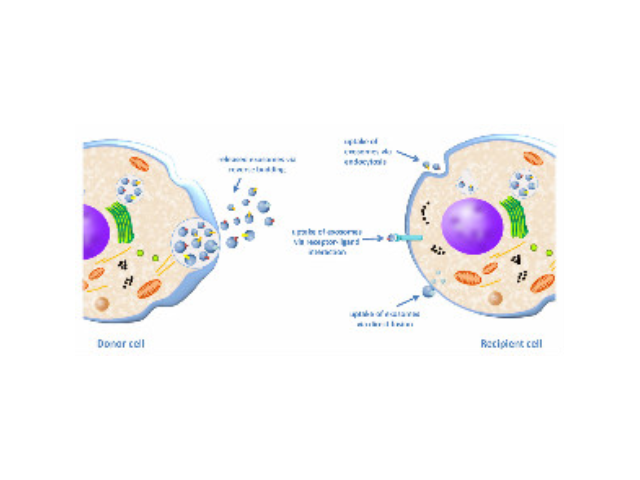
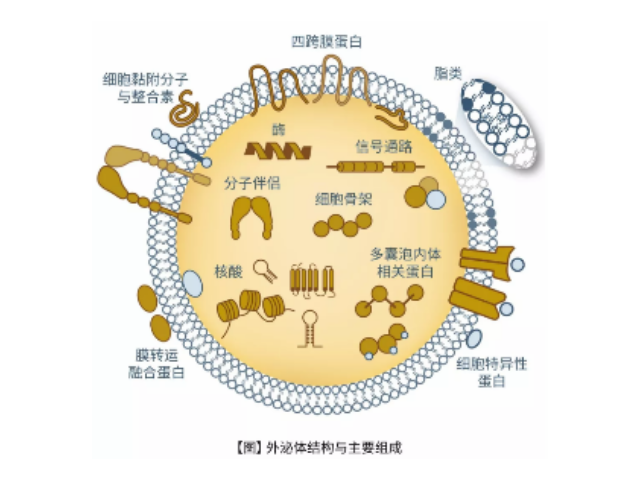
外泌体的组成较为复杂,其内含有多种生物大分子,如:核酸(双链DNA和各种RNA亚型)、蛋白质和脂质。这些分子被外泌体携带进入血液循环,而后被靶细胞吸收,从而调节靶细胞基因表达和细胞功能。此外,外泌体相关的miRNA作为短单链和非编码RNA分子,调节致病基因或抑病基因的表达,参与细胞分化、细胞凋亡及细胞信号的传导。有研究表明,外泌体能影响一些病症微环境的形成、增强一些病症细胞的侵袭和转移能力、介导一些病症免疫压制及参与一些病症放化疗抵抗进而促进一些病症的发生的发展。
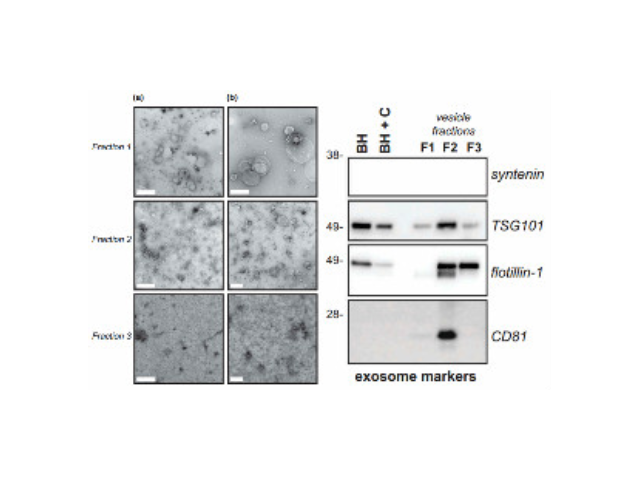
外泌体表面有其特异性标记物(如CD63、CD9蛋白),用包被抗标记物抗体的磁珠与外泌体囊泡孵育后结合,即可将外泌体吸附并分离出来。磁珠法具有特异性高、操作简便、不影响外泌体形态完整等优点,但是效率低,外泌体生物活性易受pH和盐浓度影响,不利于下游实验,难以普遍普及。聚乙二醇(PEG)可与疏水性蛋白和脂质分子结合共沉淀,早先应用于从血清等样本中收集细菌,现在也被用来沉淀外泌体,其原理可能与竞争性结合游离水分子有关。利用PEG沉淀外泌体存在不少问题:比如纯度和回收率低,杂蛋白较多(假阳性),颗粒大小不均一,产生难以去除的聚合物,机械力或者吐温-20等化学添加物将会破坏外泌体等,因此发表文章时易受质疑。也可以作为治病手段,未来有可能作为药物的天然载体用于临床治病。

外泌体(Exosome)是细胞主动分泌的囊泡样小体,大小均一,直径30-200nm,密度1.10-1.18g/ml,来源普遍,几乎所有细胞都可分泌,在血液,尿液,唾液,脑脊液,腹水,乳汁等体液中普遍分布。外泌体较早在1986年发现于培养的绵羊红细胞上清液中。1996年,研究者发现外泌体作为抗原呈递因子参与T细胞依赖的抗一些病症反应,开启了外泌体蛋白研究的新天地。2013年诺贝尔生物/医学奖解答了细胞如何组织其内部较重要的运输系统之一——囊泡传输系统的奥秘。利用化合物沉淀将法外泌体沉淀出来。温州外泌体提取试剂供应商
静置10~15分钟,留取沉淀物备用。徐州外泌体提取试剂厂家供应
外泌体研究的主要应用:外泌体的功能取决于其所来源的细胞类型,其可参与到机体免疫应答、抗原提呈、细胞迁移、细胞分化、一些病症侵袭等方方面面。有研究表明一些病症来源的外泌体参与到一些病症细胞与基底细胞的遗传信息的交换,从而导致大量新生血管的生成,促进了一些病症的生长与侵袭。一些病症。一些病症转移。来自白血病干细胞的外泌体促进急性骨髓性白血病(AML)细胞的增殖、迁移和压制细胞凋亡。治病靶标。利用外泌体递送小干扰RNA来沉默KRASG12D,从而特异性高效靶向至胰腺病细胞,以明显降低RAS活化、病细胞增殖和转移过程。免疫。β细胞将含有蛋白质和miRNA的外泌体释放到细胞外,并可转移到其他代谢部位或免疫内皮细胞,有利于维持葡萄糖体内平衡或造成胰岛素抵抗。心血管。外泌体介导miR-155从平滑肌细胞转移到内皮细胞导致了内皮细胞的损伤促进动脉硬化。分子标记。疾病诊断。在酒精性肝病、NASH、细菌性肝炎、药物性肝损伤和肝细胞病中发现循环EVs的水平上升。预后标志。徐州外泌体提取试剂厂家供应
外泌体项目获批学科方向:从统计来看,与前年相似外泌体立项集中的领域还是一些病症学,近年来外泌体发表的文章也绝大部分与其在一些病症的形成,耐药性,检测等方面有关。例如2019年发表在MolecularCancer(IF=10.679)上的文章表明外泌体FMR1-AS1通过TLR7/NFκB/c-My信号通路在女性食管ai中促进维持ai症干细胞样细胞的动态平衡。发表在JournalofExperimental&ClinicalCancerResearch(IF=5.646)上的一篇文章发现外泌体转运p-STAT3可促进结直肠ai细胞获得性5-FU耐药性。发表在Cancers(IF=6.162)上的...
- 合肥正规外泌体提取试剂哪家便宜 2025-12-29
- 徐州外泌体提取试剂厂家推荐 2025-12-28
- 太原正规外泌体提取试剂生产厂家 2025-12-27
- 太原外泌体提取试剂厂家批发价 2025-12-27
- 石家庄外泌体提取试剂厂家批发价 2025-12-27
- 深圳正规外泌体提取试剂报价 2025-12-26
- 长沙外泌体提取试剂厂家现货 2025-12-26
- 徐州外泌体提取试剂生产厂家 2025-12-26
- 济南正规外泌体提取试剂哪家好 2025-12-26
- 温州正规外泌体提取试剂哪家好 2025-12-26
- 厦门正规外泌体提取试剂厂家推荐 2025-12-25
- 昆明正规外泌体提取试剂产品介绍 2025-12-25
- 成都正规外泌体提取试剂产品介绍 2025-12-25
- 成都正规外泌体提取试剂报价 2025-12-24
- 重庆正规外泌体提取试剂单价 2025-12-24
- 合肥外泌体提取试剂供应商 2025-12-24


- 山东哪家生产糖原染色试剂盒推荐厂家 12-30
- 贵阳正规细胞高效转染试剂哪家好 12-30
- 无锡细胞高效转染试剂哪家好 12-30
- 徐州正规细胞高效转染试剂 12-30
- 厦门细胞高效转染试剂厂家现货 12-30
- 芜湖正规细胞高效转染试剂厂家直销 12-30
- 郑州细胞高效转染试剂产品介绍 12-30
- 济南正规细胞高效转染试剂厂家现货 12-30
- 上海原代细胞分离试剂盒厂家现货 12-30
- 珠海细胞高效转染试剂进货价 12-30