M-SAN HQ中盐核酸酶在生理盐条件下的优势,让其成为生物生产工艺中去除核酸污染的更好选择。经过多年的市场宣传,M-SAN HQ中盐核酸酶品质已得到多个全球TOP CDMOs认可,纳入其工艺开发筛选平台。此外,目前全球有10+临床项目涉及的病毒载体生产用到M-SAN HQ中盐核酸酶。对于同一个项目,用M-SAN HQ替代Benzonase全能核酸酶,酶量减少、HCD去除效果更优、病毒载体产量也有一定程度的提高,酶相关成本降为原有的1/5以内,极大降低了病毒载体生产成本。ArcticZymes厂家管控整个供应链及生产流程,协助客户进行文件审计及现场审计。河北中盐核酸酶70950-150

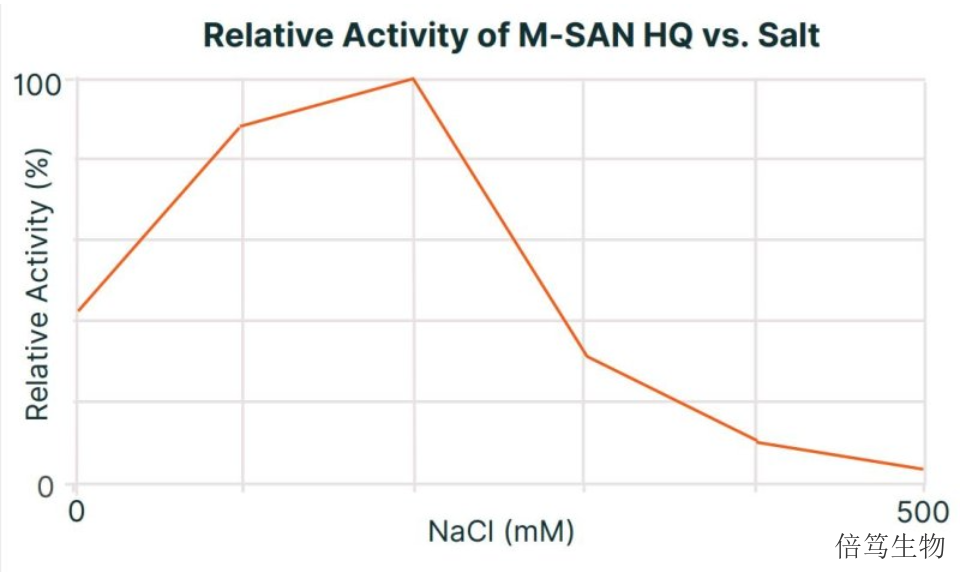
M-SAN HQ中盐核酸酶发挥酶活性的条件比较广。例如,该酶适宜的盐浓度(NaCl)范围是0mM-225mM,能耐受400mM NaCl浓度。适宜反应温度为20℃-37℃,能耐受4℃-40℃。Mg2+浓度大于0.5mM即可,在4-15mM范围即可表现更高活性。跟其他核酸酶不同,M-SAN HQ中盐核酸酶不是碱性核酸酶,其适宜pH为7.2-8.7,能耐受6.3-8.7。综合这些特点,在生理盐条件下,M-SAN HQ的酶活是传统全能核酸酶的5倍左右。因此,可以说M-SAN HQ是更适合生理盐条件下的核酸酶。河南中盐核酸酶70950致力于从深海microbe中识别新的冷适应酶,用于分子研究、IVD和biopharma领域。
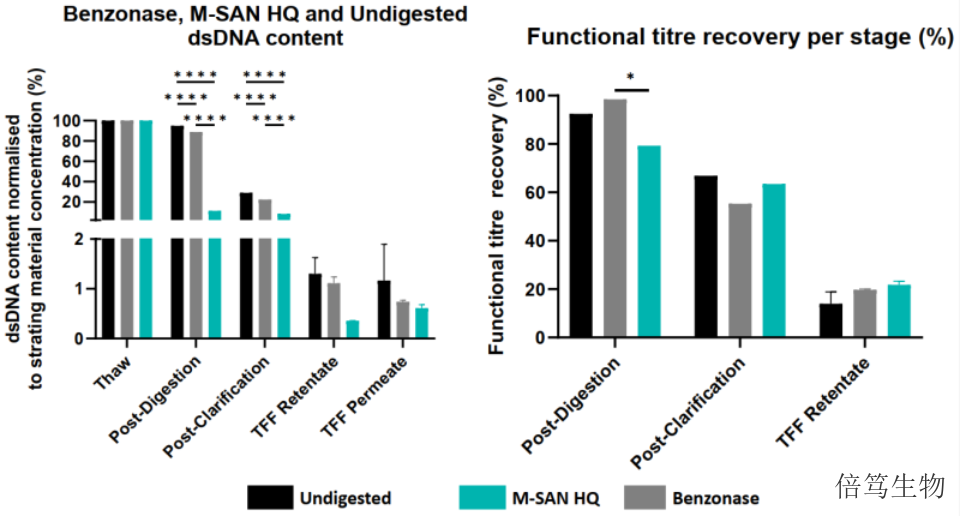
一般来说,生物生产工艺用的核酸酶以BenzonaseTM(BenzonaseTM是Merck的注册商标)为主,能高效降解任何形式(双链、单链、线状、环状)的DNA和RNA。该酶来自于大自然界普遍存在的S.Marcescen,通过E.coli发酵生产得到。该酶的适宜反应条件是低盐浓度范围(<100mM盐浓度),且酶活随着盐浓度上升而下降,在300mM盐浓度时酶活几乎丧失。对于细胞基因药物常用的两种病毒载体LV和AAV,LV由于含有脂包膜结构一般都在生理盐条件下存在,而AAV在高盐条件下不易团聚、更稳定。而在生理盐浓度及更高浓度条件下,Benzonase活性受到抑制。
ArcticZymes Technologies于2019年推出了M-SAN HQ中盐核酸酶,2021年推出对应的M-SAN HQ ELISA kit。该试剂盒原理是采用双抗夹心法定量检测各种生物制品的中间品、半成品和成品中M-SAN HQ中盐核酸酶的残留含量,特异性的anti-M-SAN作为捕获抗体偶联在孔板上,辣根过氧化酶HRP标记anti-M-SAN作为检测抗体,TMB是检测反应底物。该试剂盒特异识别M-SAN HQ中盐核酸酶,对其它核酸酶没有特异性结合。它的定量范围是0.12-7.5ng/ml;12*8strips的设计规格,使用灵活,更能降低使用成本。M-SAN HQ ELISA kit检测产品能定量检测该核酸酶,与中盐核酸酶搭配用在medicine生产。
上海倍笃生物科技有限公司(简称“倍笃生物”),由中国科学院及生物医药产业界人士,于2018年1月共同创立。公司代理多个品牌的仪器、试剂及耗材,遵守相关法规要求,如cGMP规范、ISO13485质量管理体系认证等,致力于为诊断领域如分子诊断及病原微生物检测研发等,药物研发领域如细胞基因药物、核酸药物、抗体药物、干细胞及外泌体研究等客户提供合规、高质量物料及专业服务,以期与客户共同协作,加快研发及生产进度,为客户提供更多价值。琼脂糖胶结果显示,M-SAN HQ中盐核酸酶能将HCD消化成小于8nt的片段。河北中盐核酸酶70950-150
M-SAN HQ ELISA kit规格是12*8 strip,提高使用效率。河北中盐核酸酶70950-150
通过三质粒瞬转体系生产病毒载体,会引入宿主细胞DNA残留(HCD)、蛋白残留(HCP)、工艺杂质(如antibiotics、核酸酶等外源物质)等污染,存在潜在的致瘤性和免疫原性等风险。药品监管机构一般允许生物制品中存在10ng/dose以下的残留DNA。此外,根据杂质来源、工艺以及产品类型不同,也会对HCD限度做不同要求。为了达到这个要求,一般通过核酸酶处理和色谱联用的方法。一般在细胞培养液裂解/收获、澄清收获及超滤浓缩等环节加入核酸酶处理,需要工艺摸索来确认处理方式。河北中盐核酸酶70950-150
病毒载体作为细胞药物生产的关键原材料,直接关系到细胞产品质量。载体质量的控制和工艺稳定性和批间一致性...
【详情】M-SAN HQ中盐核酸酶在生理盐条件下的优势,让其成为生物生产工艺中去除核酸污染的更好选择。经过多...
【详情】核酸酶活性受到很多因素影响,如盐浓度、pH、底物、温度等。因此,不同客户、不同项目中核酸酶的使用条件...
【详情】基因药物是指将外源基因引入靶细胞,纠正或补偿基因缺陷或异常引起的疾病的。这种策略对许多疾病的康复有很...
【详情】在抗体药物及核酸药物领域,倍笃生物产品线涵盖药物研发的全流程,主要用——RNA转染试剂、生物活性物质...
【详情】大多数研究级别的慢病毒是通过批次浓缩而不是粗制剂之后应用的,浓缩基本上是通过两步离心法产生的。在70...
【详情】在生物工艺流程中,需要使用核酸酶去除终产品中的核酸污染,而核酸酶作为外源成份,也需要在生产流程中去除...
【详情】宿主细胞DNA残留的担忧是基于致ai风险理论,特别是生产细胞系所包含的致ai序列,比如较常见腺病毒基...
【详情】基因药物是指将外源基因引入靶细胞,纠正或补偿基因缺陷或异常引起的疾病的。这种策略对许多疾病的康复有很...
【详情】基因药物常用的AAV载体有三种生产方法,分别是三质粒瞬转体系、杆状病毒表达载体体系和包装细胞体系。其...
【详情】宿主细胞DNA残留的担忧是基于致ai风险理论,特别是生产细胞系所包含的致ai序列,比如较常见腺病毒基...
【详情】上海倍笃生物科技有限公司(简称“倍笃生物”),由中国科学院及生物医药产业界人士,于2018年1月共同...
【详情】