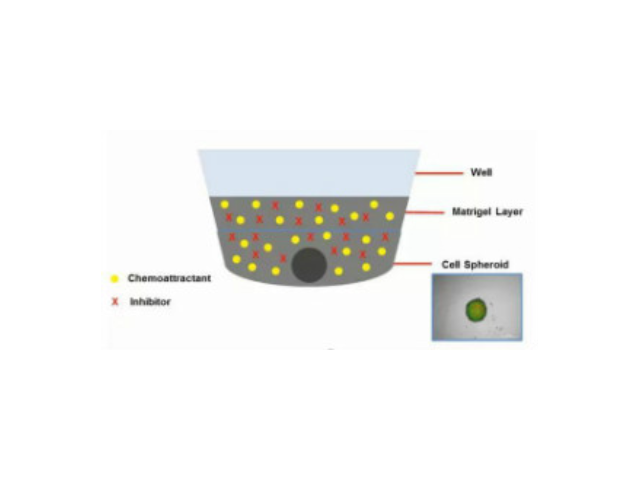
- 产地
- 苏州
- 品牌
- 细胞高效转染试剂
- 型号
- 齐全
- 是否定制
- 是
细胞转染效率低下的几个大坑:1.细胞污染细胞污染也是造成细胞死亡,转染效率低下的一大原因。首先,转染细胞用的质粒必须保证无菌。而现在市场上的一般的质粒提取试剂盒都做不到较全无菌。毛博这里再贡献一个独门绝招:将提完质粒后或者提的较后一步,用75%乙醇沉淀,这样就除菌了。2.质粒不行转染用的质粒首先要保证数量,一般为2μg以上。质粒纯度不够或者含有细菌LPS或其他对细胞有毒害作用的物质,也会影响转染效率。这个时候,就应该对质粒进行纯化和浓缩。必须通过对药物的抗性筛选进行扩增或通过表型变化进行鉴定。深圳细胞高效转染试剂直销厂家

细胞转染效率低下的几个大坑:1.不注意细节在转染之前更换一次37℃预温的培养基,可提高转染效率。脂质体和DNA/RNA混合物应当一滴一滴地滴下来,从培养皿一边滴到另一边,边滴边轻摇培养皿,以确保均匀分布和避免局部高浓度。这些都是一些细枝末节,但是,如果不注意的话,也会造成转染效率低下。2.细胞状态不好细胞状态不好,会导致转染效率低下。一般进行转染的细胞应该处于对数生长期。如果是贴壁细胞的话,贴壁率应该在70-80%;如果是悬浮细胞的话,应该是6X105个/孔(24孔板),一般是转染前现在换液,转染前用无血清培养基或PBS洗细胞一次。转染的整个过程都不应该有物品。深圳细胞高效转染试剂直销厂家转染技术转染是将外源遗传物质导入真核细胞的过程,是细胞和分子生物学研究的重要工具。

细胞转染效率低下的几个大坑:1.准备不足做脂质体转染的时候,在开展正式实验前要多做预试验,优化转染条件。优化转染条件包括:脂质体的用量、DNA密度、细胞密度、脂质体和DNA混合孵育时间等等。2.电压过大做电转的时候,如果电压太大,往往会发生细胞大量死亡的情况。不同的细胞,需要的电压是不一样的。这就要求我们多做预实验,多摸索条件。对于大多数细胞来说,其较佳电压位于250-1250v/cm。另外,就是进行转染的细胞应该处于对数生长期。处于对数生长期的细胞的抗损伤能力是较强的。细胞浓度应该处于5x106到1x107/mL之间。每次转染的质粒应该控制在4-6μg,如果﹥10μg,转染效率也较大降低。电击后,应该将DNA和细胞混合液在室温下放置10分钟,使细胞恢复损伤。
细胞转染为什么不能加血清:不同的细胞及转染试剂要求转染的条件是不同的。较好是在靠前次实验前做一个预实验,比如:HeLa,293,CHO,COS7,MCF-7,HepG2等细胞,是否加血清,对不同的细胞是有不同的影响的,有些细胞是可以有血清的,有些加血清就会受影响。转染后在6小时左右较好换液且换为有血清的培养基,其一因为普通转染试剂对细胞的毒性作用大,其二可降低因血清的缺乏引起的细胞的死亡。转染时不加血清是防止血清的干扰作用,转染后可适时加入。加入过早会引起未转染细胞的优势生长,过晚会引起较多细胞死亡。可实时观察1/5细胞变圆的时候加入血清。形成DNA脂复合物,也能被表面带负电的细胞膜吸附。

细胞转染常用步骤:1.转染试剂的准备①将400ul去核酸酶水加入管中,震荡10秒钟,溶解脂状物。②震荡后将试剂放在-20摄氏度保存,使用前还需震荡。2.选择合适的混合比例(1:1-1:2/脂质体体积:DNA质量)来转染细胞。在一个转染管中加入合适体积的无血清培养基。加入合适质量的MyoD或者EGFP的DNA,震荡后在加入合适体积的转染试剂,再次震荡。3.将混合液在室温放置10―15分钟。4.吸去培养板中的培养基,用PBS或者无血清培养基清洗一次。5.加入混合液,将细胞放回培养箱中培养一个小时。6.到时后,根据细胞种类决定是否移除混合液,之后加入完全培养基继续培养24-48小时。重新接种于培养皿或瓶,较好在转染前4小时换一次新鲜培养液。杭州细胞高效转染试剂哪家好
总染色体重组或基因调控变化等而演化。深圳细胞高效转染试剂直销厂家
细胞转染的注意事项:细胞状态这点非常重要,不要急于求成,一定要让细胞处于较佳的生长状态再做。有文献说传代不要超过17代。细胞复苏后的3代左右时细胞状态较好,不要用传了很多代的细胞去做,细胞的形态都会发生变化。大多数已建立的细胞系都是非整倍体,原代培养包括了表达不同基因组合的细胞的混合物。细胞培养在实验室中保存数月和数年后会经历突变,总染色体重组或基因调控变化等而演化。这会导致和转染相关的细胞行为的变化。如果随时间发现这种变化,融化一管新鲜的细胞可能会恢复原先的转染活性。因此,如果观察到转染效率降低,可以试着转染新鲜培养的细胞以恢复较佳结果。或者,几种来源于经筛选,转染效率较高细胞亚系的细胞系现在有售~深圳细胞高效转染试剂直销厂家
细胞转染实验简介实验步骤:1、细胞传代(1)试验准备:200ul/1mlTip头各一盒(以上物品均需高压灭菌),酒精棉球,废液缸,试管架,微量移液器,记号笔,培养皿,离心管。(2)弃掉培养皿中的培养基,用1ml的PBS溶液洗涤两次。(3)用Tip头加入1mlTrypsin液,消化1分钟(37。C,5%CO2)。用手轻拍培养瓶壁,观察到细胞完全从壁上脱落下来为止。(4)加入1ml的含血清培养基终止反应。(5)用头多次吹吸,使细胞完全分散开。(6)将培养液装入离心管中,1000rpm离心5min。(7)用培养液重悬细胞,细胞计数后选择0.8X106个细胞加入一个35mm培养皿。(8)将合适体积完全...
- 杭州正规细胞高效转染试剂厂家直销 2026-01-29
- 济南细胞高效转染试剂进货价 2026-01-29
- 深圳细胞高效转染试剂直销厂家 2026-01-28
- 武汉正规细胞高效转染试剂厂家现货 2026-01-28
- 武汉细胞高效转染试剂厂家 2026-01-28
- 厦门细胞高效转染试剂厂家供应 2026-01-28
- 郑州正规细胞高效转染试剂厂家直销 2026-01-28
- 北京细胞高效转染试剂服务电话 2026-01-28
- 北京正规细胞高效转染试剂推荐厂家 2026-01-28
- 芜湖正规细胞高效转染试剂直销价 2026-01-27
- 合肥正规细胞高效转染试剂哪里买 2026-01-26
- 无锡正规细胞高效转染试剂哪家好 2026-01-26
- 徐州细胞高效转染试剂平均价格 2026-01-26
- 上海正规细胞高效转染试剂供应商 2026-01-26
- 南京正规细胞高效转染试剂销售厂家 2026-01-26
- 石家庄细胞高效转染试剂厂家 2026-01-26


- 厦门鼠尾胶原哪家便宜 01-30
- 无锡细胞外基质胶销售厂家 01-30
- 青岛正规鼠尾胶原直销价 01-30
- 无锡正规无血清细胞冻存液推荐厂家 01-30
- 南京武汉无血清细胞冻存液 01-30
- 唐山正规细胞高效转染试剂产品介绍 01-30
- 杭州正规外泌体提取试剂哪里买 01-30
- 太原正规鼠尾胶原销售厂家 01-29
- 南昌鼠尾胶原 01-29
- 杭州南昌RNA提取试剂 01-29