RIP-qPCR实验在特定情况下被广泛应用。首先,当研究者需要验证特定RNA与蛋白质之间的相互作用时,RIP-qPCR是一个理想的选择。通过该技术,可以精确地检测和定量与特定蛋白质结合的RNA,从而证实它们之间的直接联系。其次,RIP-qPCR实验在研究RNA结合蛋白的功能和调控机制方面具有重要应用。通过分析不同条件下RNA与蛋白质的结合情况,可以深入了解RNA结合蛋白在转录后调控、RNA稳定性、定位以及翻译等方面的作用。此外,当研究者对特定细胞类型或组织中的RNA-蛋白质相互作用感兴趣时,RIP-qPCR也是一个合适的方法。该技术可以用于研究特定生理或病理状态下RNA与蛋白质的结合模式,为疾病机制的解析和新药开发提供重要线索。总之,RIP-qPCR实验在验证RNA与蛋白质相互作用、研究RNA结合蛋白功能和调控机制以及探索特定细胞类型或组织中的RNA-蛋白质相互作用等方面具有广泛应用。它为科学家提供了一种灵敏、特异且定量的方法来研究细胞内复杂的RNA-蛋白质相互作用网络。RIP-seq实验广泛应用于研究全基因组RNA-蛋白质相互作用及转录后调控机制。湖北RNA蛋白相互作用检测RIP PCR检测
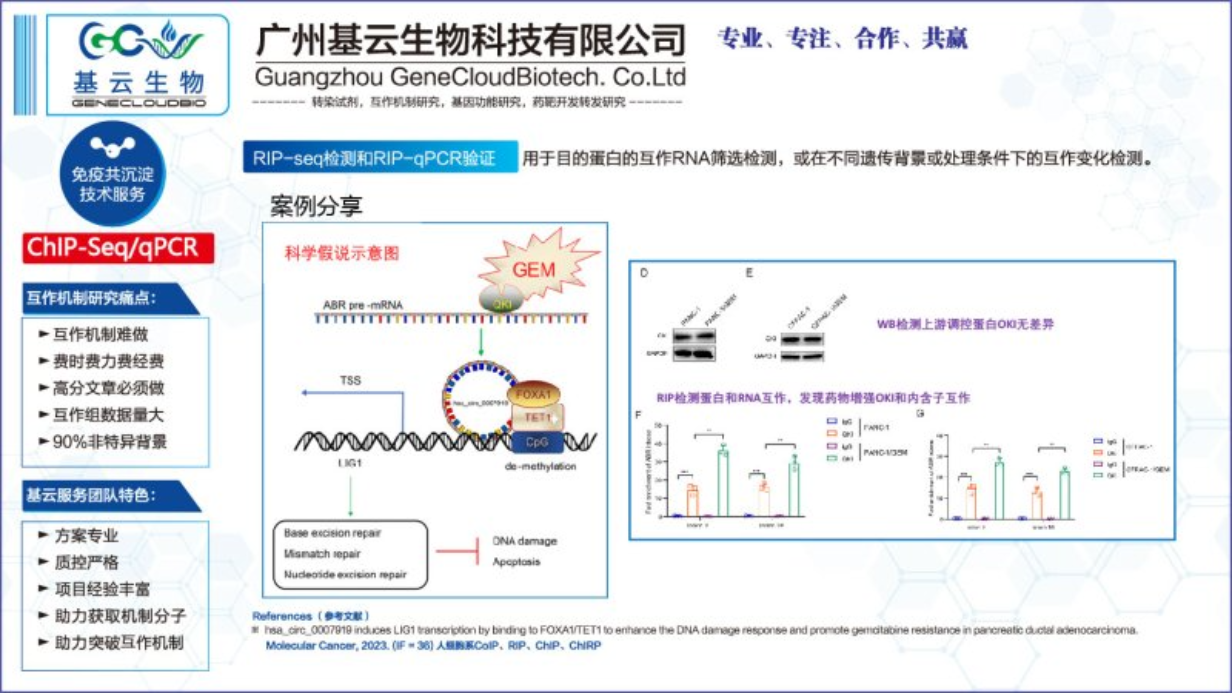
RIP-Seq检测和RIP-qPCR验证要点:
实验设计:尽量进行实验组别设计和生物学重复检测,提高后续验证的阳性率。常规过表达单组(AbIPvsIgGIP);动态互作组学(实验组vs对照组vsIgG组)。根据目的设计适当的生物学重复。如果后续以RIP-Seq数据进行互作组标准分析,则需要3-4组生物学重复;如果后续以寻找关键互作RNA,进行深入的机制研究,则建议1-2次生物学重复。经验显示单次重复假阳性率达90%。RIP-Seq强烈建议设置实验组别和生物学重复检测。
蛋白表达和细胞量:细胞用量要不少于5e7(金标准:320g离心细胞量50μl,保障项目用量)。本底低表达蛋白,建议使用过表达组进行检测。蛋白表达可根据WB结果或初步根据数据库判定。
抗体关键质控:抗体特异性与亲和效价要求高,尽量采用标签抗体或经过CoIP效果验证的抗体。抗体质量参差不齐(WB能检测到预期条带不到1/2,能检测到良好结果的不到1/4)和存在非特异性结合(几乎所有的抗体都存在非特异结合,部分非特异结合条带远大于目的条带),RIP-Seq需做WB和IP-WB质控。抗体可参考数据库。
互作蛋白筛选和验证:数据分析以信号强度作为强阳筛选,以文献查阅,功能匹配,批量RIP-qPCR验证,提高验证成功率。 湖南RNA蛋白相互作用检测RIP-PCRRIP实验旨在精确地研究目标RNA与特定蛋白质的相互作用,实验设计有哪些关键步骤。
RIP实验RNA结合蛋白-RNA复合物的免疫沉淀(RIP)免疫沉淀方法步骤:
制备RIP免疫共沉淀缓冲液。每次免疫沉淀需要900μL的RIP免疫沉淀缓冲液。每个反应在860µL的RIP洗涤缓冲液中加入35μL的0.5MEDTA和5µL的RNase抑制剂。
将第二节第10步中的试管放在磁性分离器上,并丢弃上清液。在每根试管中加入900µL的RIP免疫共沉淀缓冲液。
快速解冻RIP裂解液,在4℃下以14000rpm离心10分钟。取出100µL的上清液,加入RIP免疫沉淀缓冲液中的每个磁珠-抗体复合物。免疫共沉淀反应的ZUI终体积将为1.0mL。
RIP-seq实验在特定情况下被广泛应用。首先,当研究者需要在全基因组范围内研究RNA与特定蛋白质的相互作用时,RIP-seq是一个理想的选择。通过该技术,可以捕获与特定蛋白质结合的RNA,并利用高通量测序技术对其进行测序分析,从而了解RNA与蛋白质的结合模式和调控网络。其次,RIP-seq实验适用于研究RNA结合蛋白在转录后调控中的作用。通过分析RNA结合蛋白所结合的RNA序列,可以揭示其在mRNA稳定性、定位、剪接以及翻译等方面的调控机制,为深入了解基因表达调控提供重要信息。此外,当研究者对特定生理或病理状态下RNA与蛋白质的相互作用感兴趣时,RIP-seq也是一个合适的方法。该技术可以用于比较不同条件下RNA与蛋白质的结合差异,从而揭示疾病发生、发展过程中的关键调控因子和潜在诊疗靶点。总之,RIP-seq实验适用于全基因组范围内研究RNA与特定蛋白质的相互作用、探索RNA结合蛋白在转录后调控中的作用以及研究特定生理或病理状态下的RNA-蛋白质相互作用等方面。它为科学家提供了一种详细、高通量的方法来解析细胞内复杂的RNA-蛋白质相互作用网络。RIP实验是一种强大的技术,用于研究细胞内RNA与蛋白质的相互作用。
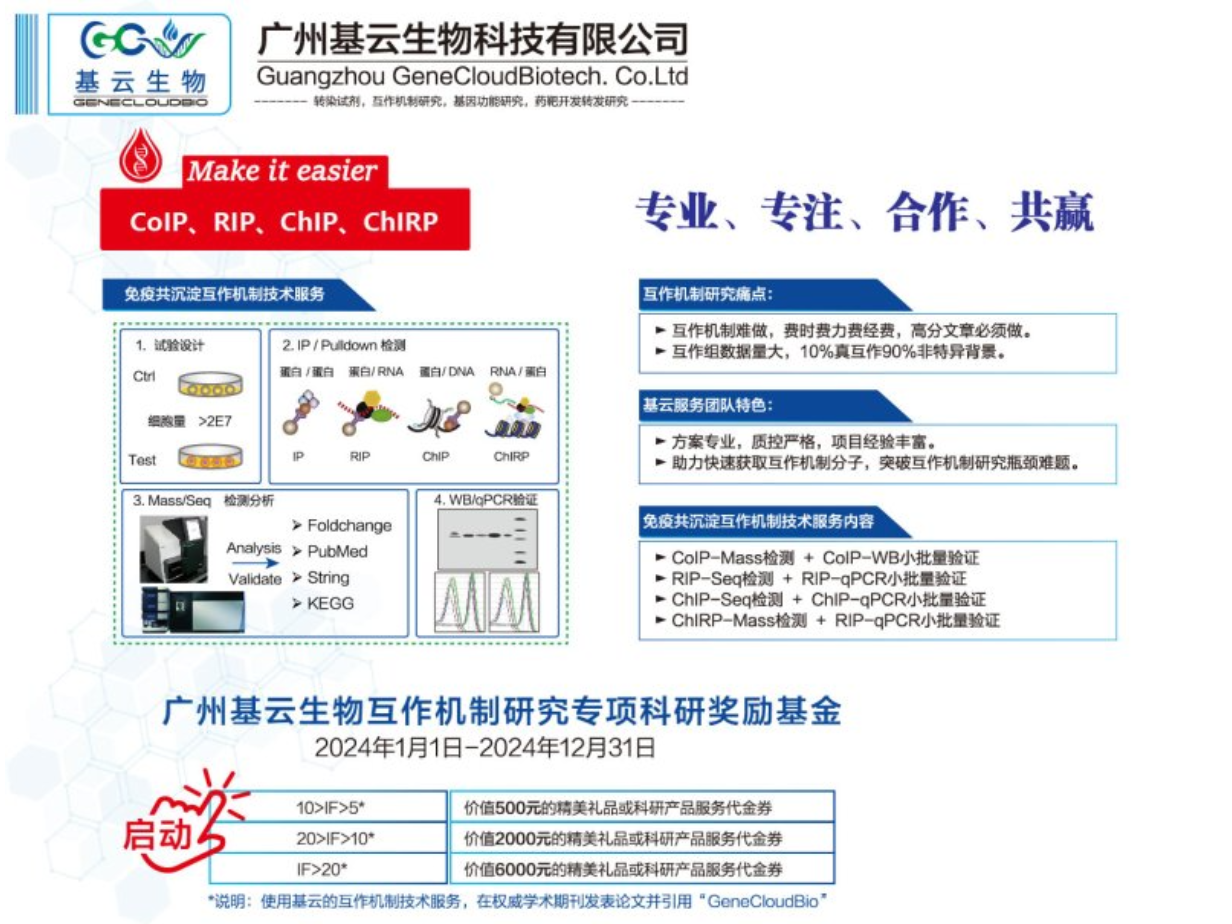
RIP-qPCR实验的引物设计至关重要,它直接影响到实验的特异性和灵敏度。以下是引物设计的主要要求。特异性:引物应具有高特异性,确保只扩增目标RNA分子,避免非特异性扩增。设计时,应避免与其他基因或RNA存在互补序列。长度与GC含量:引物长度通常在18-25bp之间,GC含量适中(40%-60%),以保证引物的稳定性和退火效率。避免引物二聚体:引物间不应存在互补序列,特别是3’端,以防止引物二聚体的形成。跨内含子设计:对于基因编码区的RNA,引物尽量跨越内含子设计,以避免基因组DNA的污染。3’端修饰避免:引物的3’端不能进行任何修饰,且必须是G或C,因为这两种碱基配对较为稳定,有利于引物的延伸。引物自身互补性:引物自身不应存在互补序列,以避免折叠成发夹结构,影响引物与模板的结合。与模板紧密互补:引物应与模板序列紧密互补,确保PCR的高效扩增。遵循这些要求设计的引物,将大程度提高RIP-qPCR实验的准确性和可靠性。在实验前,还应对设计的引物进行验证,确保其满足实验需求。RIP实验在医药领域具有广泛的应用场景。广东RNA蛋白相互作用检测RIP RT-PCR
做好RIP-qPCR实验,应该注意哪些关键问题。湖北RNA蛋白相互作用检测RIP PCR检测
RIP实验RNA结合蛋白-RNA复合物的免疫沉淀(RIP)免疫沉淀方法:
将所有的试管在4°C下旋转孵育3小时至过夜。
将免疫沉淀管短暂离心,放置在磁性分离器上,弃用上清液。
从磁铁上取下试管。每管中加入0.5mLRIP洗涤缓冲液,短暂涡旋。(重复清洗5次)
在后面一次洗涤中,将500µL的珠子悬液中各取出50µL,通过免疫印迹法检测免疫沉淀的效率。在1XSDS-PAGE加载缓冲液中重新悬浮珠子,然后在95°C加热,可以洗脱蛋白质。然后可以离心,上清液直接应用于SDS-PAGE上。 湖北RNA蛋白相互作用检测RIP PCR检测